Pytanie 1
Podłoże, które jest wykorzystywane do uzyskiwania hodowli z wysoką liczbą drobnoustrojów danego szczepu, nazywamy
Wynik: 36/40 punktów (90,0%)
Wymagane minimum: 20 punktów (50%)
Podłoże, które jest wykorzystywane do uzyskiwania hodowli z wysoką liczbą drobnoustrojów danego szczepu, nazywamy
Błąd kwasowy oraz błąd sodowy wprowadzają ograniczenia w użyciu elektrody
Analityczne mnożniki dla wagowego oznaczania wapnia (M = 40,08 g/mol) w formie CaC2O4 (M = 128,10 g/mol), CaCO3 (M = 100,09 g/mol) oraz CaO (M = 56,08 g/mol) wynoszą odpowiednio
Zjawisko polegające na przepuszczaniu rozpuszczalnika przez membranę półprzepuszczalną z roztworu o wyższym stężeniu do roztworu o niższym stężeniu substancji rozpuszczonej określa się mianem
W warunkach neutralnych manganian(VII) potasu ulega redukcji do
Substancją wskaźnikową w miareczkowaniu alkacymetrycznym nie jest
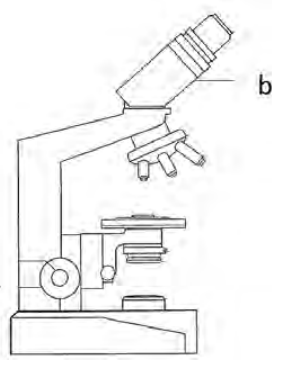
Na rysunku przedstawiającym schemat mikroskopu optycznego literą b oznaczono
Jakie składniki są potrzebne do przygotowania pożywki, która pozwala na hodowlę bakterii?
Zjawisko polegające na chemicznej modyfikacji substancji, które prowadzi do powstania innego związku, łatwiejszego do oznaczenia przy użyciu konkretnej metody, to
Badanie szczegółowej struktury komórek roślinnych oraz zwierzęcych, jak również rozmieszczenia atomów w kryształach metali i minerałów, jest możliwe dzięki wykorzystaniu mikroskopu
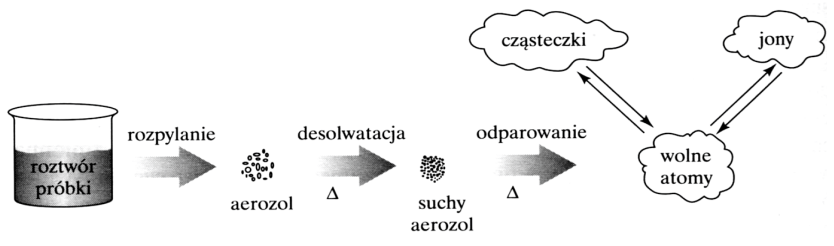
Na schemacie przedstawiono procesy, które zachodzą podczas przygotowania próbek do badań z wykorzystaniem
Batymetr jest narzędziem do pozyskiwania próbek
Jaką właściwość fizyczną substancji można określić przy użyciu areometru?
| Zawartość chlorowodoru w próbce można obliczyć wg wzoru: mB = CA · VA⁄1000 · pB⁄pA · MB w którym: mB – masa analizowanej substancji [g] CA – stężenie titranta [mol/dm3] VA – objętość titranta [cm3] pA i pB – współczynniki stechiometryczne reakcji, odpowiednio titranta i substancji oznaczanej MB – masa molowa substancji oznaczanej; 36,46 g/mol Do oznaczenia zużyto średnio 20,0 cm3 titranta, którego stężenie wynosiło 0,1000 mol/dm3. Obliczono masę próbki, która wyniosła 0,07292 g. |
| A. | HCl + NaOH → NaCl + H2O |
| B. | 3HCl + Al(OH)3 → AlCl3 + 3H2O |
| C. | 2HCl + Na2CO3 → 2NaCl + H2O + CO2 |
| D. | 2HCl + Na2B4O7 + 5H2O → 4H3BO3 + 2NaCl |
Po przeprowadzeniu procesu elektrolizy wodnego roztworu określonego związku, na katodzie pojawił się wodór, a na anodzie tlen. Który z tych związków został poddany elektrolizie?
W której z reakcji opisanych równaniami mangan ulega utlenieniu?
Drobnoustroje posiadające zdolność do rozkładu białek oraz peptydów charakteryzują się właściwościami
Który spośród tłuszczów wymienionych w przedstawionej tabeli wykazuje najbardziej nienasycony charakter?
| Liczby właściwe wybranych tłuszczów | ||
|---|---|---|
| Rodzaj tłuszczu | Liczba zmydlania (LZ) mg KOH / g tłuszczu | Liczba jodowa (LJ) g I₂ / 100 g tłuszczu |
| Olej lniany | 187 – 197 | 169 – 192 |
| Olej sojowy | 188 – 195 | 114 – 138 |
| Olej rzepakowy | 167 – 179 | 94 – 106 |
| Tran wielorybi | 170 – 202 | 102 – 144 |
| Masło krowie | 218 – 245 | 25 – 38 |
| Smalec wieprzowy | 193 – 200 | 46 – 66 |
Zamieszczone w tabeli dane techniczne dotyczą
| Specyfikacja urządzenia | |
|---|---|
| zakres pH | od -2,00 do 16,00pH |
| zakres temperatury | od -9,9 do 120,0 C |
| rozdzielczość: pH | 0,01pH |
| rozdzielczość temperatury | 0,1°C |
| kalibracja | automatyczna 1 lub 2 punktowa z 5 buforami |
| elektroda | szklana HI 1131B, elektrolitowa, kabel 1m |
| wymiary | 240*182*74mm |
| waga | 1,1kg |
Do roztworu zawierającego jony Ca2+ i Ni2+ o równym stężeniu dodawano kroplami roztwór węglanu sodu. Iloczyn rozpuszczalności węglanu wapnia wynosi 4,8x10-9, natomiast węglanu niklu 1,7x10-7. Który węglan wytrąci się jako pierwszy?
W celu przeprowadzenia bezpośredniego testu ELISA należy postąpić zgodnie z procedurą

Eliminacja twardości wody w metodzie fizyko-chemicznej polega na użyciu
Związek chemiczny Ag2CrO4, który powstaje podczas analizy chlorków, charakteryzuje się kolorem
Jakie sole nie podlegają procesowi hydrolizy?
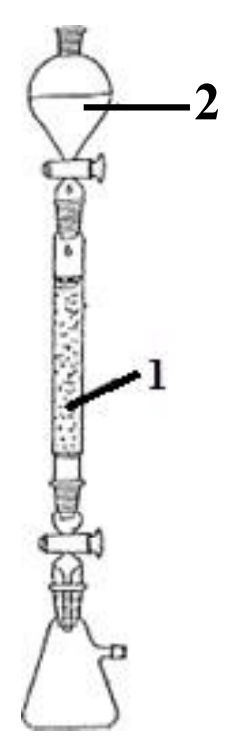
Na rysunku przedstawiono zestaw do chromatografii kolumnowej. Cyfrą 1 oznaczono
Do technik rozdzielania należy
Wszelkie działania, które powinny zostać podjęte w celu usunięcia zidentyfikowanej niezgodności CCP (krytyczne punkty kontroli) w systemie HACCP, to działania
System HACCP – System Analizy Zagrożeń i Krytycznych Punktów Kontroli, stanowi zbiór wzajemnie powiązanych ze sobą procedur, które w całości tworzą system zarządzania bezpieczeństwem żywności.
W Polsce ustalono normy dla pyłów PM10 na trzech poziomach (dobowych):
- poziom dopuszczalny 50 ug/m3 - oznacza, że jakość powietrza jest niezadowalająca, jednak nie powoduje poważnych skutków dla zdrowia ludzkiego.
- poziom informowania 200 ug/m3 - wskazuje, że jakość powietrza jest zła i konieczne jest ograniczenie aktywności na świeżym powietrzu, ponieważ norma została przekroczona czterokrotnie.
- poziom alarmowy 300 ug/m3 - wskazuje, że jakość powietrza jest bardzo zła, norma została przekroczona sześciokrotnie i należy zdecydowanie ograniczyć przebywanie na zewnątrz, a najlepiej pozostać w domu, zwłaszcza osoby z chorobami.
Na stacji Monitoringu Środowiska dokonano pomiarów zanieczyszczenia powietrza pyłem PM10, uzyskując średnią dobową 0,25 mg/m3. Z przeprowadzonej analizy wynika, że
W jakiej proporcji molowej EDTA reaguje z jonami Zn2+?
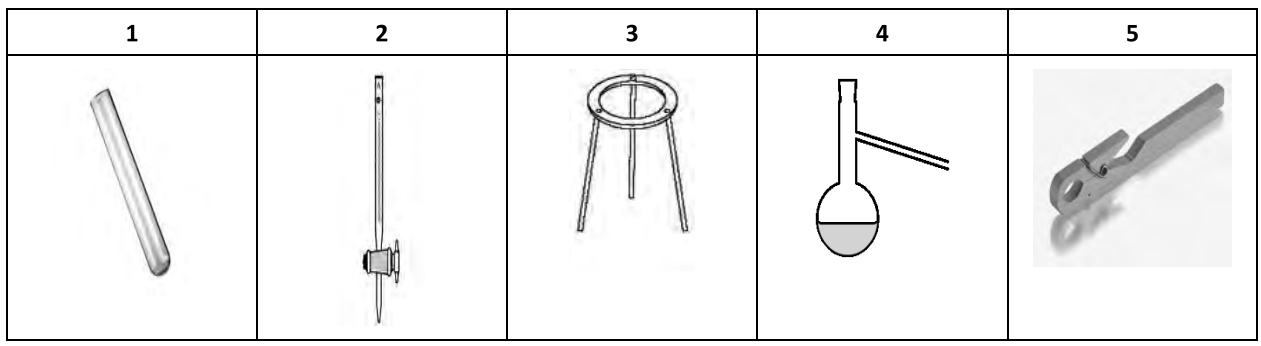
W celu wykonania analizy mieszaniny kationów grup I - V należy wybrać sprzęt oznaczony w tabeli numerami:
| Palnik gazowy | Kolba stożkowa | Drut platynowy na pręcie szklanym | Biureta | Płytka ceramiczna do eksperymentów kroplowych | Kolba miarowa |
| 1 | 2 | 3 | 4 | 5 | 6 |
Jakie urządzenie wykorzystuje się do hodowli bakterii w warunkach beztlenowych?
W próbce wody oznaczono zawartość rozpuszczonego tlenu metodą Winklera. Wyniki zestawiono w tabeli. Korzystając z zamieszczonego wzoru, określ zawartość rozpuszczonego tlenu (x) w badanej próbce wody.
$$ x = \frac{V_1 \cdot 0,2 \cdot 1000}{V_p} $$
\( x \) – zawartość tlenu rozpuszczonego; \( \text{mgO}_2/\text{dm}^3 \)
\( V_1 \) – objętość roztworu \( \text{Na}_2\text{S}_2\text{O}_3 \) o stężeniu \( 0,025 \, \text{mol}/\text{dm}^3 \) zużyta do miareczkowania; \( \text{cm}^3 \)
\( V_p \) – objętość próbki wody użytej do miareczkowania; \( \text{cm}^3 \)
\( 0,2 \) – ilość tlenu odpowiadająca \( 1 \, \text{cm}^3 \) roztworu \( \text{Na}_2\text{S}_2\text{O}_3 \) o stężeniu \( 0,025 \, \text{mol}/\text{dm}^3 \); \( \text{mg} \)
| Objętość próbki; \( V_p \) | Objętość roztworu \( \text{Na}_2\text{S}_2\text{O}_3 \) o stężeniu \( 0,025 \, \text{mol}/\text{dm}^3 \) zużyta do miareczkowania; \( V_1 \) |
| \( 100 \, \text{cm}^3 \) | \( 8,4 \, \text{cm}^3 \) |
Przedstawiony wzór opisuje titrant stosowany podczas miareczkowania
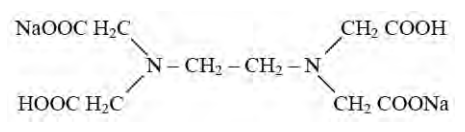
Jaką metodę można wykorzystać do oznaczania białek w produktach żywnościowych?
Czym jest efekt wspólnego jonu?
Aby wykryć obecność jonów SO42- w wodzie, należy zastosować roztwór
W próbce wody, w której stwierdzono obecność 60,0 mg żelaza, dokonano oznaczenia jego zawartości za pomocą spektrofotometrii, uzyskując wynik 59,1 mg. Jaki jest błąd względny tego oznaczenia?
Określ typ destylacji, który polega na przemianie składnika mieszaniny substancji organicznych w stan pary w temperaturze niższej od jego temperatury wrzenia.
W celu wykrycia cukrów metodą Tollensa należy wybrać zestaw sprzętu oznaczonego w tabeli numerami:
Białka, których cząsteczki mają wiązania peptydowe, w reakcji z jonami miedzi(II) w środowisku zasadowym tworzą kompleks o barwie fioletowej. Stopień intensywności barwy jest proporcjonalny do liczby wiązań peptydowych. Tę zależność można wykorzystać do oznaczeń