Pytanie 1
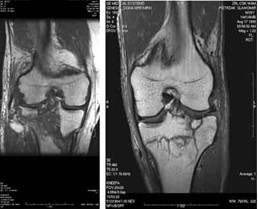
Którą metodą i w której płaszczyźnie zostało wykonane badanie stawu kolanowego zobrazowane na zdjęciach?
Wynik: 29/40 punktów (72,5%)
Wymagane minimum: 20 punktów (50%)
Którą metodą i w której płaszczyźnie zostało wykonane badanie stawu kolanowego zobrazowane na zdjęciach?

Ligand stosuje się
Rytm alfa i beta rejestruje się podczas badania
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
Hiperfrakcjonowanie dawki w radioterapii oznacza napromieniowywanie pacjenta
Które informacje należy zamieścić na strzykawce z radiofarmaceutykiem przygotowanym przez technika elektroradiologa?
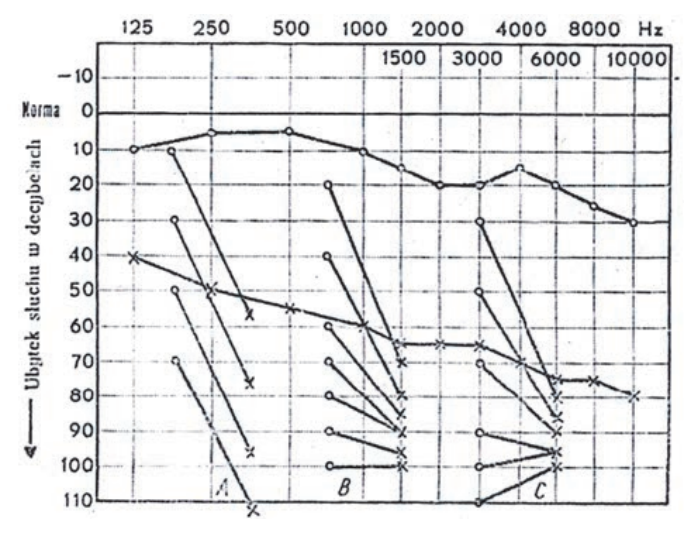
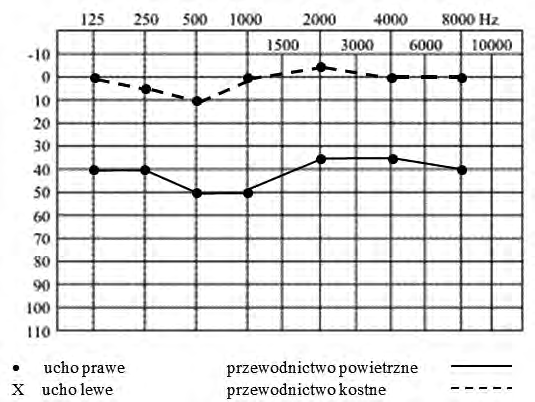
Audiogram przedstawia próbę
Podczas badania EEG otwarcie oczu powoduje
Przy ułożeniu do zdjęcia AP czaszki płaszczyzna
Na schemacie oznaczono
Do zdjęcia prawych otworów międzykręgowych kręgosłupa szyjnego pacjent stoi w skosie
Na schemacie oznaczono
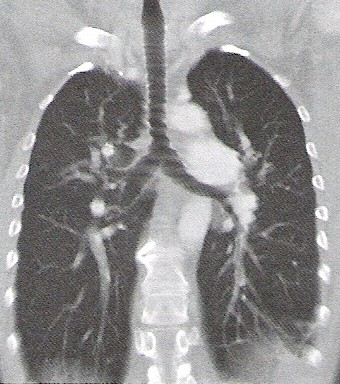
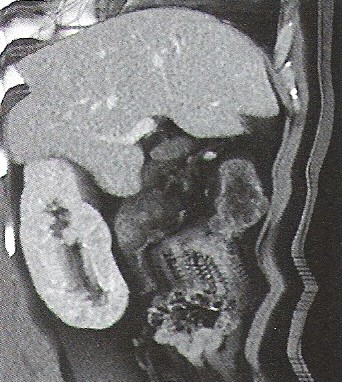
Na którym obrazie TK uwidoczniony jest artefakt spowodowany ruchami oddechowymi pacjenta?

Zdjęcie którego zęba górnego zlecił na skierowaniu lekarz stomatolog?
Która sekwencja obrazowania MR wykorzystuje impulsy RF o częstotliwości rezonansowej tłuszczu do tłumienia sygnału pochodzącego z tkanki tłuszczowej?
W której technice obrazowania zostają zarejestrowane jednocześnie dwa przeciwbieżne kwanty promieniowania gamma o równej energii 511 keV?
Scyntygrafia kości „whole body” jest wskazana podczas diagnostyki
Miejscem wykonania pomiaru densytometrycznego z kości przedramienia jest
Jaki jest cel stosowania bolusa w radioterapii?
Elementem pomocniczym w radioterapii, zapewniającym powtarzalność ułożenia w pozycji terapeutycznej, a także unieruchomienie pacjenta, jest
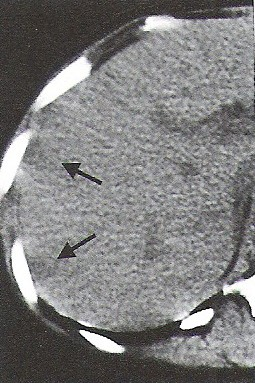
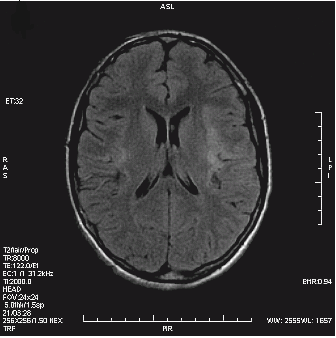
Która przyczyna spowodowała powstanie artefaktu widocznego na zamieszczonym obrazie MR?
Zgodnie ze standardami do wykonania zdjęcia bocznego czaszki, należy zastosować kasetę o wymiarze
Droga przewodnictwa powietrznego fali akustycznej przebiega przez
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Na radiogramie uwidoczniono
Który program wtórnej rekonstrukcji obrazów TK pozwala na odwzorowanie wnętrza jelita grubego, tchawicy i oskrzeli?
Objawem późnego odczynu popromiennego po teleradioterapii jest
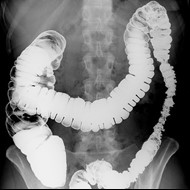
Przedstawiony obraz radiologiczny został zarejestrowany podczas badania jelita
„Ognisko zimne” w obrazie scyntygraficznym określa się jako
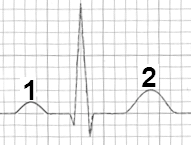
W badaniu EKG elektrodę przedsercową V4 należy umocować
W leczeniu izotopowym tarczycy podaje się
Na podstawie zapisu badania audiometrycznego rozpoznano u pacjenta uszkodzenie słuchu
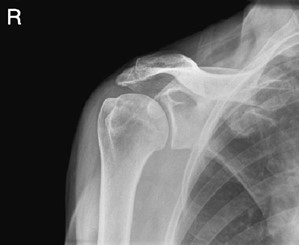
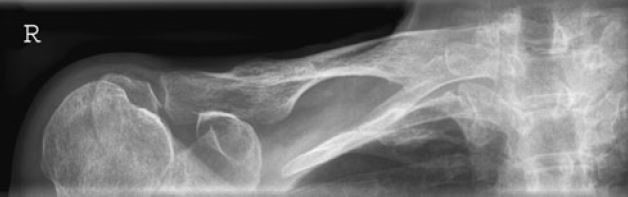
W jakiej projekcji i pod jakim kątem padania promienia centralnego został wykonany radiogram obojczyka?
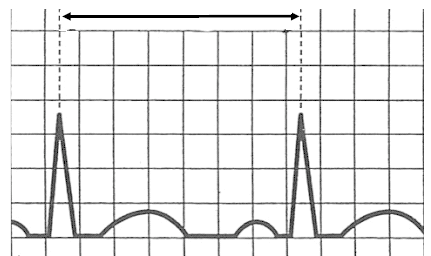
Zarejestrowane na elektrokardiogramie miarowe fale f w kształcie „zębów piły” poprzedzielane prawidłowymi zespołami QRS są charakterystyczne dla
W celu maksymalnego ograniczenia dawki promieniowania badanie rentgenowskie u dzieci należy wykonać
Promieniowanie rentgenowskie powstaje w wyniku hamowania
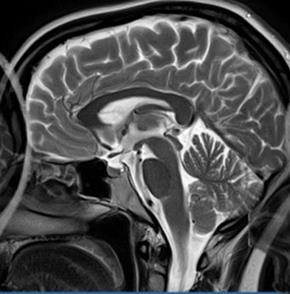
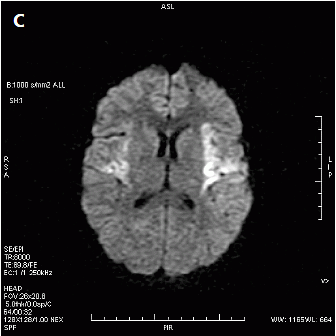
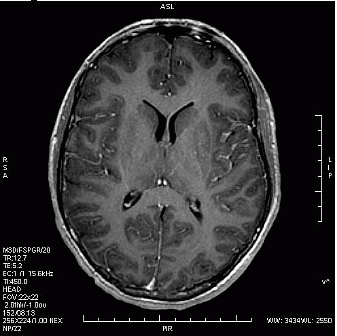
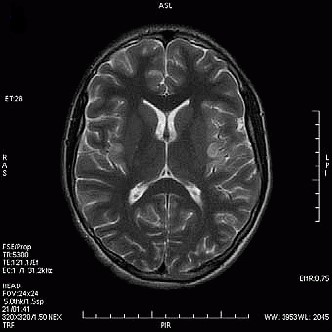
Który obraz MR mózgu został wykonany w sekwencji DWI?
W ułożeniu do rentgenografii AP stawu kolanowego promień główny pada
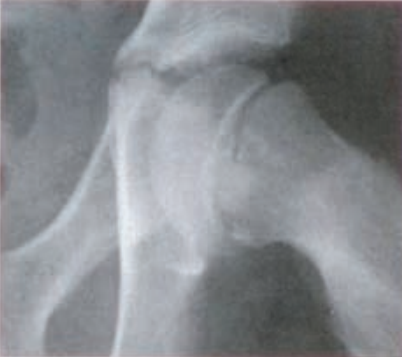
Na rentgenogramie przedstawione jest złamanie Saltera-Harrisa typu
Jaki rozmiar kasety należy zastosować, wykonując standardowe zdjęcie stawu kolanowego w projekcji bocznej?