Pytanie 1
W radiologii analogowej lampy rentgenowskiej z tubusem używa się do wykonania zdjęcia
Wynik: 30/40 punktów (75,0%)
Wymagane minimum: 20 punktów (50%)
W radiologii analogowej lampy rentgenowskiej z tubusem używa się do wykonania zdjęcia
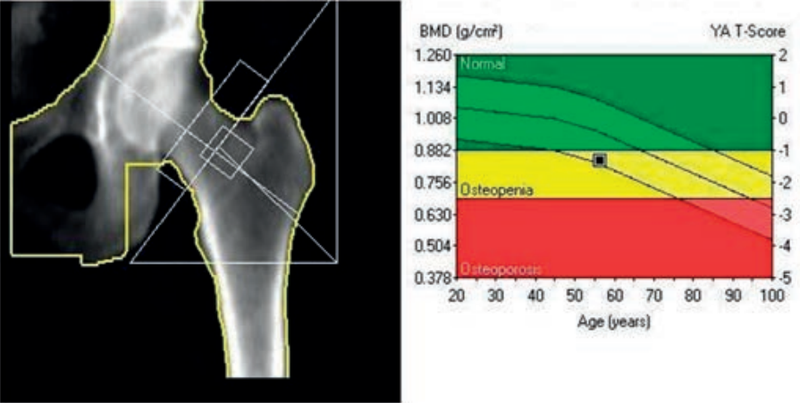
Zamieszczone obrazy związane są z badaniem
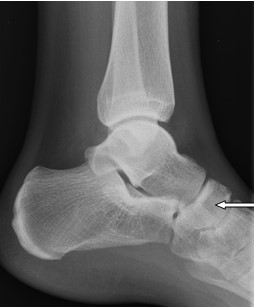
Na radiogramie strzałką oznaczono
Który zestaw zdjęć narządów klatki piersiowej należy wykonać u pacjenta z podejrzeniem lewostronnego zapalenia płuc?
Jednostką indukcji magnetycznej jest
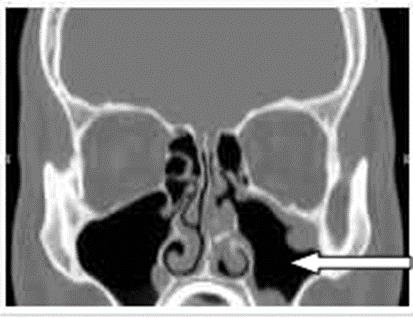
Na zamieszczonym obrazie TK strzałką zaznaczono zatokę
Do zdjęcia lewobocznego kręgosłupa lędźwiowo-krzyżowego pacjenta należy ułożyć na boku
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
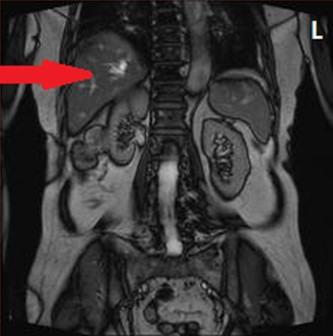
Na obrazie MR jamy brzusznej strzałką wskazano
Który radioizotop jest stosowany w scyntygrafii perfuzyjnej mózgu?
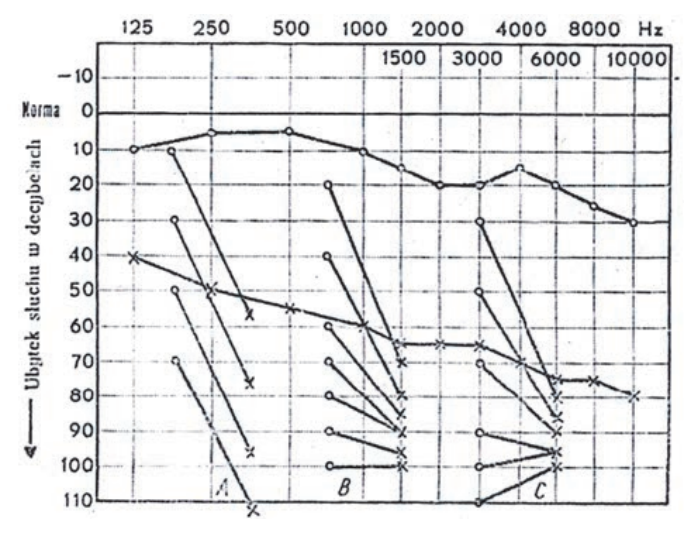
Audiogram przedstawia próbę
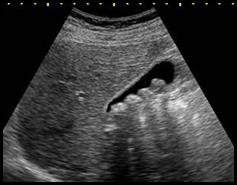
Którą strukturę anatomiczną uwidoczniono na zamieszczonym obrazie USG?
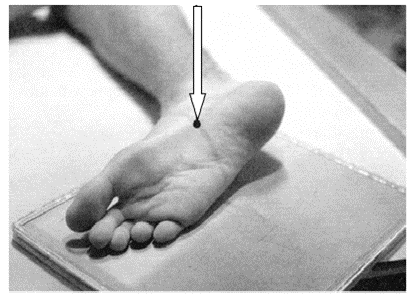
Na zamieszczonej ilustracji przedstawiono ułożenie pacjenta do wykonania zdjęcia rentgenowskiego
Warstwa półchłonna (WP) służy do obliczania
W medycznym przyspieszaczu liniowym jest generowana wiązka fotonów o energii w zakresie
Jakie symbole mają odprowadzenia kończynowe dwubiegunowe w badaniu EKG?
Wiązka elektronów najczęściej stosowana jest do leczenia zmian nowotworowych w obrębie
Hiperfrakcjonowanie dawki w radioterapii oznacza napromieniowywanie pacjenta
Zarejestrowany na obrazie TK artefakt jest spowodowany
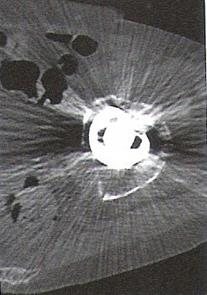
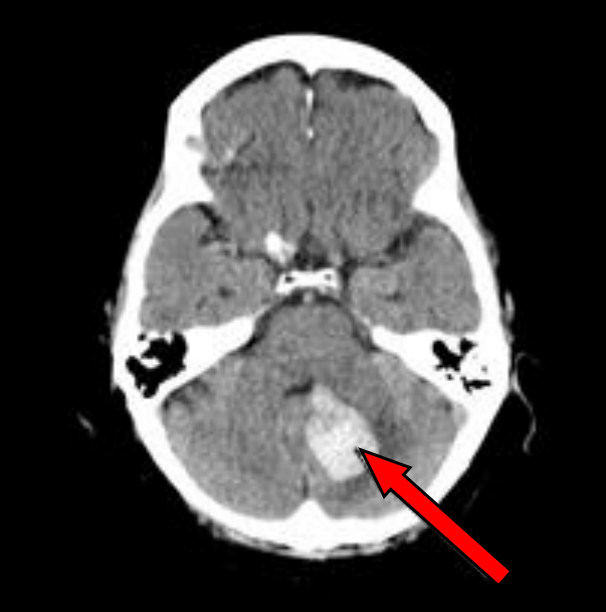
Na przekroju poprzecznym TK mózgu strzałką wskazano obszar
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
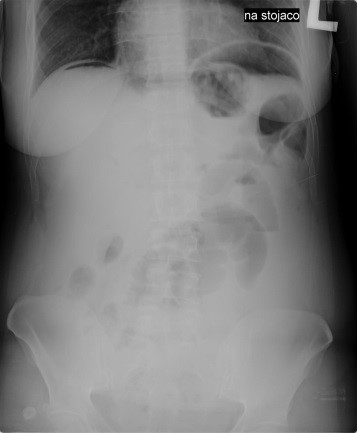
Radiogram jamy brzusznej uwidacznia
Podczas wykonywania zdjęcia rentgenowskiego lewobocznego czaszki promień centralny powinien przebiegać
Wskazaniem do wykonania scyntygrafii perfuzyjnej jest
Dobierz dla standardowego pacjenta projekcję, pozycję i sposób ułożenia kasety o wymiarach 30 cm x 40 cm do zdjęcia przeglądowego układu moczowego.
| Projekcja | Pozycja | Ułożenie kasety | |||
|---|---|---|---|---|---|
| 1. | AP | 3. | stojąca | 5. | poprzeczne |
| 2. | PA | 4. | leżąca | 6. | podłużne |
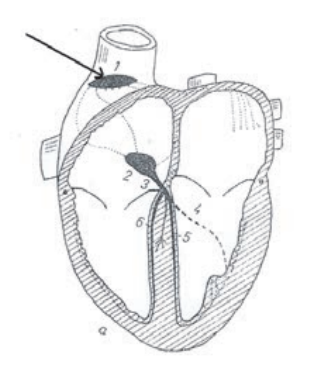
Strzałką na schemacie oznaczono
W badaniu EEG elektrody referencyjne przymocowane do płatka ucha to
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
Do pomiaru dawek indywidualnych u osób narażonych zawodowo na promieniowanie rentgenowskie są stosowane
Elementem systemu rejestracji obrazu, w którym fotony promieniowania X są bezpośrednio konwertowane na sygnał elektryczny, jest
Który obszar napromieniania wskazano na ilustracji strzałką?
Folia wzmacniająca umieszczona w kasecie rentgenowskiej emituje pod wpływem promieniowania X światło
W lampie rentgenowskiej promieniowanie X powstaje w wyniku hamowania
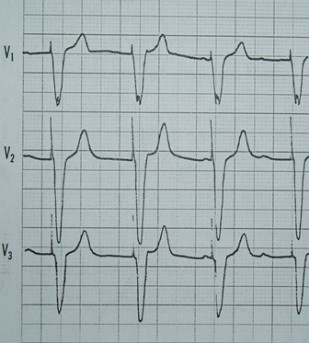
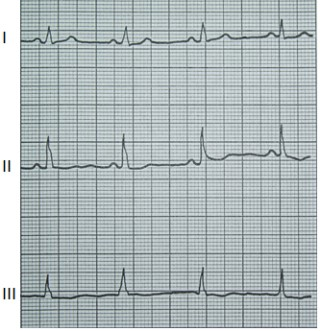
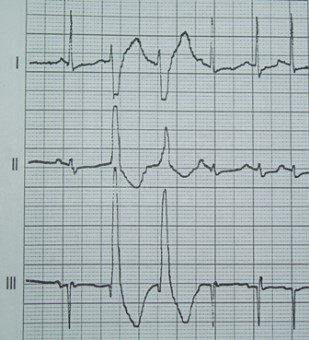
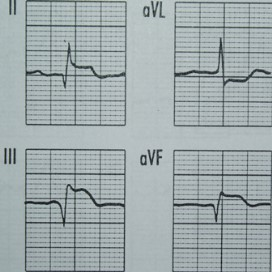
Na którym z zapisów EKG została uwidoczniona fala Pardee'go?
Który radioizotop jest emiterem promieniowania alfa?
Który wynik badania tympanometrycznego potwierdza, że słuch badanego pacjenta jest w granicach normy?
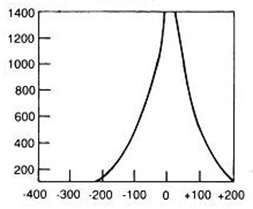
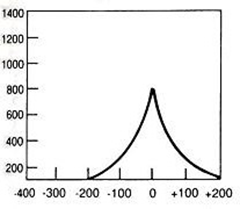
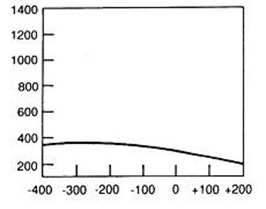
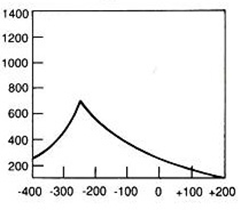
Hiperfrakcjonowanie dawki w radioterapii oznacza napromienienie pacjenta
Dobierz dla standardowego pacjenta projekcję, pozycję i sposób ułożenia kasety o wymiarach 30 cm × 40 cm do zdjęcia przeglądowego układu moczowego.
| Projekcja | Pozycja | Ułożenie kasety | |||
|---|---|---|---|---|---|
| 1. | AP | 3. | stojąca | 5. | poprzeczne |
| 2. | PA | 4. | leżąca | 6. | podłużne |
Jakie są wielkości mocy dawki stosowanej w brachyterapii HDR?
W trakcie obrazowania metodą rezonansu magnetycznego wykorzystywane jest zjawisko wysyłania sygnału emitowanego przez