Pytanie 1
Oblicz, ile moli gazu można zebrać w pipecie gazowej o pojemności 500 cm3, jeśli gaz będzie gromadzony w warunkach normalnych. (W normalnych warunkach jeden mol gazu ma objętość 22,4 dm3)
Wynik: 37/40 punktów (92,5%)
Wymagane minimum: 20 punktów (50%)
Oblicz, ile moli gazu można zebrać w pipecie gazowej o pojemności 500 cm3, jeśli gaz będzie gromadzony w warunkach normalnych. (W normalnych warunkach jeden mol gazu ma objętość 22,4 dm3)
W jakim stosunku objętościowym należy połączyć roztwór o stężeniu 5 mol/dm3 z wodą destylowaną, aby uzyskać roztwór o stężeniu 3 mol/dm3?
Jaką masę siarczanu(VI) miedzi(II)-woda(1/5) należy poddać suszeniu, aby otrzymać 300 g soli bezwodnej?
| CuSO4 · 5H2O → CuSO4 + 5H2O |
| (MCuSO4·5H2O = 249,5 g/mol, MCuSO4 = 159,5 g/mol, MH2O = 18,0 g/mol) |
Sód metaliczny powinien być przechowywany w laboratorium
Rozdział składników mieszaniny w chromatografii odbywa się dzięki ich różnym
Jakie substancje są potrzebne do uzyskania nierozpuszczalnego wodorotlenku cynku?
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Jakie jest stężenie roztworu HNO3, który powstał w wyniku połączenia 50 cm3 roztworu HNO3 o stężeniu 0,2 mol/dm3 oraz 25 cm3 roztworu HNO3 o stężeniu 0,5 mol/dm3?
Ile masy kwasu mrówkowego jest wymagane do uzyskania 11,2 dm3 tlenku węgla(II) (w warunkach normalnych) w procesie odwodnienia kwasu mrówkowego (M = 46 g/mol) za pomocą kwasu siarkowego(VI), zakładając efektywność procesu na poziomie 70%?
Na zdjęciu przedstawiono proces

Na rysunku przedstawiono urządzenie służące do poboru próbek

Symbol "In" znajduje się na
Przy transporcie próbek wody zaleca się, aby próbki były
Transformacja zolu w żel to zjawisko określane jako
Na podstawie informacji zawartej na pipecie, została ona skalibrowana na
Na podstawie informacji zawartych w tabeli określ, który parametr spośród podanych należy oznaczyć w pierwszej kolejności.
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godziny |
Zestaw do filtracji nie zawiera
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
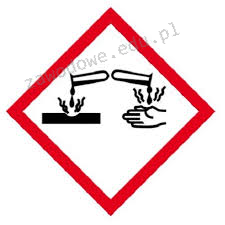
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Jakie urządzenie wykorzystuje się do pobierania próbek gazów?
W wypadku oblania skóry kwasem mrówkowym należy
| Wyciąg z karty charakterystyki Skład: kwas mrówkowy 80%, woda 11-20% Pierwsza pomoc. Po narażeniu przez drogi oddechowe. Natychmiast wezwać lekarza. Po kontakcie ze skórą. Zanieczyszczoną skórę natychmiast przemyć dużą ilością wody. |
Użycie płuczek jest konieczne w trakcie procesu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakim kolorem zazwyczaj oznacza się przewody w instalacji gazowej w laboratorium?
Oblicz, jaką ilość węglanu sodu w gramach należy przygotować, aby uzyskać 500 cm3 roztworu tej soli o stężeniu 0,1000 mol/dm3.
MNa = 23 g/mol, MC = 12 g/mol, MO = 16 g/mol
Aby oczyścić zwęglone osady w probówce, należy zastosować
Jakie jest znaczenie skrótu: cz. na etykiecie reagentu chemicznego?
Przedstawiono wyciąg z karty charakterystyki substancji chemicznej. Na podstawie informacji zawartej w zamieszczonym fragmencie karty wskaż wzór chemiczny substancji, której można użyć jako materiału neutralizującego lodowaty kwas octowy.
Kwas octowy lodowaty 99,5% Materiały zapobiegające rozprzestrzenianiu się skażenia i służące do usuwania skażenia Jeżeli to możliwe i bezpieczne, zlikwidować lub ograniczyć wyciek (uszczelnić, zamknąć dopływ cieczy, uszkodzone opakowanie umieścić w opakowaniu awaryjnym). Ograniczyć rozprzestrzenianie się rozlewiska przez obwałowanie terenu; zebrane duże ilości cieczy odpompować. Małe ilości rozlanej cieczy przysypać niepalnym materiałem chłonnym (ziemia, piasek oraz materiałami neutralizującymi kwasy, np. węglanem wapnia lub sodu, zmielonym wapieniem, dolomitem), zebrać do zamykanego pojemnika i przekazać do zniszczenia. Zanieczyszczoną powierzchnię spłukać wodą. Popłuczyny zebrać i usunąć jako odpad niebezpieczny. |
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |
Wykorzystując pipetę gazową, pobrano próbkę azotu (Mn2 = 28 g/mol) o objętości 250 cm3 w standardowych warunkach. Jaką masę ma zmierzony azot?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką objętość w warunkach standardowych zajmie 1,7 g amoniaku (masa molowa amoniaku wynosi 17 g/mol)?
Mianowanie roztworu o stężeniu przybliżonym można wykonać poprzez
Próbka laboratoryjna posiadająca cechy higroskopijne powinna być pakowana
Gęstość cieczy w próbce określa się bezpośrednio za pomocą
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Sączenie osadów kłaczkowatych odbywa się przy użyciu sączków
Zbiór próbek pierwotnych tworzy próbkę