Pytanie 1
Przy pomocy polarymetru wykonuje się pomiar
Wynik: 38/40 punktów (95,0%)
Wymagane minimum: 20 punktów (50%)
Przy pomocy polarymetru wykonuje się pomiar
W opisie metody analitycznej zapisano:
Który parametr metody analitycznej opisano?
| Różnica w otrzymanych wynikach dwóch oznaczeń wykonanych równocześnie lub w krótkim przedziale czasu na tej samej próbce, przez tego samego analityka, w takich samych warunkach, nie może przekraczać 1,5 g na 100 g oznaczanej próbki. |
Ilościowa analiza polegająca na dodawaniu równoważnej ilości roztworu odczynnika miareczkującego oraz precyzyjnym pomiarze jego objętości to analiza
Zawartość całkowitą białka oznacza się przy użyciu spektrofotometru w metodzie
Przewodnictwo właściwe roztworu \( \text{KNO}_3 \) wynosi \( 8{,}9 \cdot 10^{-3} \, \text{S} \cdot \text{cm}^{-1} \). W jakiej odległości powinny być ustawione elektrody o powierzchni \( 5 \, \text{cm}^2 \), aby przewodnictwo roztworu wynosiło \( 5 \, \text{mS} \)?
Wzór do obliczeń:$$ \frac{1}{R} = G = \frac{\kappa \cdot S}{l} $$gdzie:
\( R \) – oznacza opór przewodnika
\( G \) – przewodnictwo elektryczne
\( \kappa \) – przewodnictwo właściwe
\( S \) – powierzchnia elektrod
\( l \) – odległość elektrod względem siebie
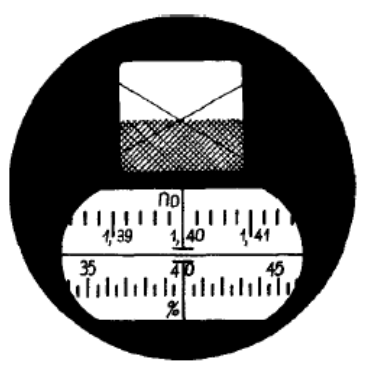
Na rysunku przedstawione jest pole widzenia
Najczęściej wykorzystywanym odczynnikiem do barwienia próbek mikroskopowych jest
Biosensor, który znajduje zastosowanie w rozpoznawaniu aminokwasów, to
W ramce scharakteryzowano odczynniki
| Łączą się z danym jonem ubocznym, wiążąc go w trwałe zespoły i tym samym wyłączają go z udziału w roztworze lub obniżają znacznie jego stężenie. |
Wykonano badanie, działając świeżo strąconym wodorotlenkiem miedzi(II) na wodny roztwór badanej próbki. Obserwacje zamieszczono w tabeli. Z obserwacji zawartych w tabeli wynika, że badaniu poddano
| Odczynnik | Obserwacje |
|---|---|
| Cu(OH)2 na gorąco | ceglastoczerwony osad |
| Cu(OH)2 na zimno | klarowny, szafirowy roztwór |
Związek chemiczny, który posiada skrót Gly-Ala-Leu-Ala-Tyr i został zidentyfikowany w trakcie badań analitycznych, to
Substancja chemiczna o najwyższym poziomie czystości nazywana jest
Przeprowadzano analizę jakościową próbki według schematu:
Badana próbka zawierała kation
| badany roztwór zawierający jony X2+ | |
| + roztwór HCl | |
| XCl2↓ biały osad | |
| + H2O: ogrzać | |
| roztwór X2+: podzielić na 2 części | |
| + roztwór KI | oziębić |
| XI2 żółty osad | XCl2↓ biały osad |
Jakim wskaźnikiem posługujemy się w argentometrycznym oznaczaniu chlorków w roztworze soli fizjologicznej?
Roztwór zawierający aniony I grupy analitycznej poddano identyfikacji metodą chromatografii cienkowarstwowej. Na chromatogramie uwidoczniono dwie plamki w odległości 5,6 cm i 3,5 cm od linii startu. Odległość czoła eluenta od linii startu wyniosła 10,1 cm, a wartości wskaźników Rf wzorców anionów wynoszą jak w tabeli. Które z anionów zawierała badana próbka?
| Anion | Cl- | Br- | I- | SCN- |
|---|---|---|---|---|
| Wskaźnik Rf | 0,243 | 0,352 | 0,554 | 0,648 |
Który zestaw kationów zawiera kationy reagujące z roztworem (NH4)2C03 w obecności wodnego roztworu amoniaku i w wyniku tych reakcji wytrącają się białe osady?
| A. | B2+, Sr2+, Ca2+ |
| B. | Mg2+, Na+, K+ |
| C. | Fe3+, Al3+, Cr3+ |
| D. | Ag+, H22+, Pb2+ |
Z analizy danych w tabeli rozpuszczalności wynika, że w formie osadu z roztworu wytrąci się
| Na+ | Fe2+ | Pb2+ | Mg2+ | Fe3+ | Ag+ | Zn2+ | |
|---|---|---|---|---|---|---|---|
| SO42- | ↓ | ↓ | |||||
| Br- | ↓ | ↓ | |||||
| Cl- | ↓ | ↓ | |||||
| S2- | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ |
Aby obliczyć wartość absorbancji substancji X, dokonano pomiaru absorbancji mieszaniny X i Y oraz samej substancji Y przy tych samych długościach fali. Jeśli AX+Y = 0,84, a AY = 0,56, to jaką wartość ma AX?
Wskaź zespół substancji, które przyczyniają się do twardości niewęglanowej wody?
Do technik analitycznych opartych na reakcjach chemicznych należy
Przeniesienie pasma absorpcyjnego w kierunku fal krótszych to
Czym jest płyn Lugola?
Wśród wskaźników stosowanych w analizach kompleksometrycznych znajdują się
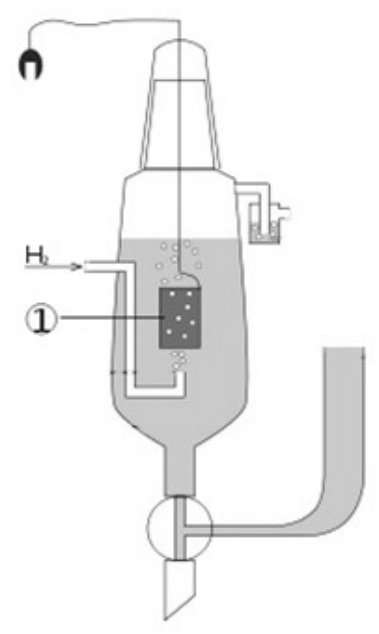
Na schemacie przedstawiającym elektrodę wodorową, cyfrą 1 oznaczono
Wskaż błędnie określone efekty reakcji analitycznych kationów I grupy.
| Odczynnik strącający | Reakcje analityczne | |||
|---|---|---|---|---|
| Ag+ | Hg22+ | Pb2+ | ||
| A. | HCl | biały osad AgCl rozpuszczalny w NH3·H2O | biały osad Hg2Cl2 | biały osad PbCl2 rozpuszczalny w gorącej wodzie |
| B. | H2SO4 | biały Ag2SO4 (ze stężonych roztworów), rozpuszczalny w gorącej wodzie | biały osad Hg2SO4 rozpuszczalny w wodzie królewskiej | biały osad PbSO4 rozpuszczalny w roztworze NaOH |
| C. | NaOH | brunatny osad Ag2O rozpuszczalny w NH3·H2O | czarny osad HgO i Hg | biały osad Pb(OH)2 rozpuszczalny w roztworze NaOH |
| D. | NH3aq | brunatny jon kompleksowy Ag(NH3)2+ | biały osad soli amidortęciowej rozpuszczalny w stężonym HNO3 | żółty osad Pb(OH)2 rozpuszczalny w gorącej wodzie |
Zjawisko zatrzymywania obcych jonów wewnątrz strącanej substancji podczas analizy wagowej określa się mianem
W tabeli podano kryteria energetyczno-emisyjne dla paliw stałych.
Na podstawie analizy danych zamieszczonych w tabeli wskaż numer próbki, która spełnia kryteria energetyczno-emisyjne w zakresie badanych parametrów.
| Parametr | Jedn. | Kryteria kwalifikacyjne | |
|---|---|---|---|
Analiza techniczna | Zawartość popiołu, Ar | % | ≤ 12 |
| Wartość opałowa, Qr | kJ/kg | ≥ 24 000 | |
| Zawartość siarki całkowitej, Sr | % | < 1 | |
| Spiekalność -Liczba Rogi, RI *3 | - | ||
| Temperatura spiekania popiołu w atmosferze utleniającej, TS(O) | °C | ≥ 900 | |
| Temperatura mięknienia popiołu w atmosferze utleniającej, TA(O) | °C | ≥ 1200 | |
Stężenie zanieczyszczeń w spalinach *1 | Ditlenek siarki, SO2 | [mg/m3] | ≤ 1100 |
| Tlenek węgla, CO | [mg/m3] | ≤ 1200 | |
| Tlenki azotu, NOx*2 | [mg/m3] | ≤ 400 | |
| Pył | [mg/m3] | ≤ 125 | |
| Całkowite zanieczyszczenia organiczne, TOC | [mg/m3] | ≤ 75 | |
| Wielopierścieniowe węglowodory aromatyczne, 16 WWA wg EPA | [mg/m3] | ≤ 5 | |
| Benzo(a)piren, B(a)P | [mg/m3] | ≤ 75 | |
| Badany parametr | Nr próbki | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| SO2 [mg/m3] | 1000 | 1100 | 1200 | 1100 |
| CO [mg/m3] | 900 | 990 | 1200 | 1300 |
| Pył [mg/m3] | 150 | 125 | 125 | 125 |
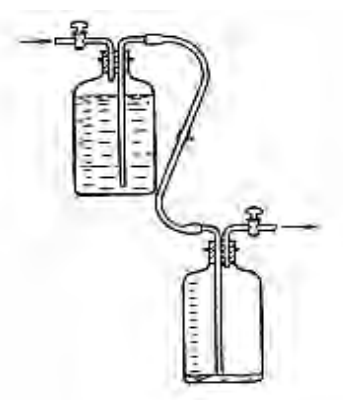
Przy pomocy zamieszczonego na rysunku urządzenia można oznaczyć
W świadectwie jakości roztworu amoniaku cz. podana jest informacja: zawartość amoniaku 30÷32% m/m Uwzględniając informacje zawarte w tabeli, określ gęstość tego roztworu w temperaturze 20°C.
| Zależność gęstości roztworu amoniaku od stężenia w 20°C | |||||||
|---|---|---|---|---|---|---|---|
| % wagowy | 1 | 6 | 10 | 16 | 20 | 26 | 30 |
| gęstość [g/cm³] | 0,9939 | 0,9730 | 0,9575 | 0,9362 | 0,9229 | 0,9040 | 0,8920 |
Ile wynosi stężenie molowe roztworu CuSO4, którego absorbancja mierzona w kuwecie o grubości 20 mm ma wartość 0,90? Molowy współczynnik absorpcji s = 3000 dm3/molcm.

W ramce opisano
| Jest to system zapewnienia jakości badań, odnoszący się do procesów organizacyjnych i warunków w jakich niekliniczne badania z zakresu bezpieczeństwa i zdrowia człowieka i środowiska są planowane, przeprowadzane, monitorowane, zapisywane, przechowywane i sprawozdawane. |
Z opisu wynika, że do oznaczenia wapnia w glukonianie wapnia stosuje się miareczkowanie
| Opis oznaczania zawartości wapnia w glukonianie wapnia |
|---|
| Oznaczenie polega na strąceniu jonów wapnia szczawianem amonu w postaci szczawianu wapnia CaC2O4 zgodnie z równaniem reakcji: Ca2+ + C2O42- → CaC2O4. Odsączony osad CaC2O4 rozpuszcza się w kwasie siarkowym(VI) zgodnie z równaniem reakcji: CaC2O4 + 2H+ → H2C2O4 + Ca2+ Wydzielony kwas szczawiowy, w ilości równoważnej ilości wapnia w próbce, odmiareczkowuje się mianowanym roztworem KMnO4. |
Wartość logarytmu stosunku natężenia wiązki padającej do natężenia wiązki przechodzącej przez badany ośrodek (log I0/I) nazywana jest
Przedstawione równania reakcji zachodzą podczas oznaczania chlorków metodą
| Ag+ + Cl- → AgCl 2Ag+ + CrO42- → Ag2CrO4 |
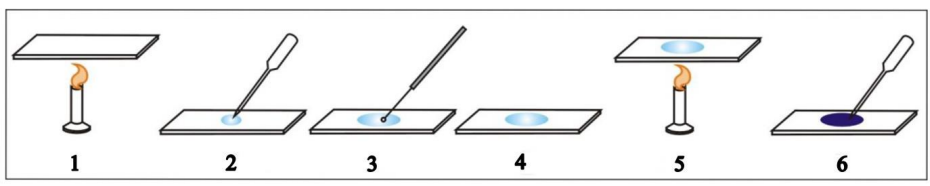
Na ilustracji przedstawiono poszczególne etapy wykonania preparatu mikroskopowego utrwalonego. Cyfrą 3 oznaczono
Który sprzęt laboratoryjny przedstawiono na ilustracji?

Które urządzenie przedstawiono na rysunku?

Równanie iloczynu rozpuszczalności związku Ca₃(PO₄)₂, który jest trudno rozpuszczalny, opisuje się następująco:
W celu identyfikacji cukru przeprowadzono następujące doświadczenia:
Identyfikowanym cukrem jest
| Doświadczenie | Wynik doświadczenia |
|---|---|
| Próba Trommera | pozytywna |
| Próba Tollensa | pozytywna |
| Hydroliza | nie zachodzi |
W trakcie oznaczania ChZT wody, określanego jako utlenialność, substancją utleniającą jest