Pytanie 1
Aby przeprowadzać ręczną obróbkę szkła w laboratorium, konieczne jest posiadanie okularów ochronnych oraz rękawic.
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Aby przeprowadzać ręczną obróbkę szkła w laboratorium, konieczne jest posiadanie okularów ochronnych oraz rękawic.
Jakie urządzenie jest wykorzystywane do oczyszczania próbki gazowej?
Nie należy używać do czyszczenia szklanych naczyń laboratoryjnych
Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
Do metalowego sprzętu laboratoryjnego używanego w praktykach analitycznych zalicza się
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
W celu przygotowania 100 cm3 roztworu mianowanego, jaką kolbę należy zastosować?
Jakie środki stosuje się do czyszczenia szkła miarowego, które zostało zanieczyszczone substancjami tłustymi?
Wskaź sprzęt konieczny do przeprowadzenia miareczkowania?
Wodę do badań mikrobiologicznych powinno się pobierać do butelek
Którą z poniższych czynności należy wykonać, aby zapewnić wysoką dokładność pomiaru masy substancji podczas przygotowywania próbki do analizy chemicznej?
W standardowym układzie destylacyjnym, który ma ukośną chłodnicę, wykorzystuje się chłodnicę
Wody pobrane ze studni powinny być przewożone w szczelnie zamkniętych butelkach z przezroczystego materiału
Naczynia miarowe kalibrowane "na wlew" mają oznaczenie w postaci symbolu
Nie należy używać gorącej wody do mycia
Elementami brakującymi w zestawie przedstawionym na rysunku są
W celu rozdrabniania niewielkich ilości bardzo twardego materiału wykorzystuje się moździerze
Podczas pomiaru masy substancji w naczyniu wagowym na wadze technicznej, dla zrównoważenia masy na szalce zastosowano odważniki: 10 g, 5 g, 500 mg, 200 mg, 200 mg, 50 mg, 20 mg, 10 mg oraz 10 mg. Masa substancji razem z naczynkiem wyniosła
Jakie oznaczenie znajduje się na naczyniach szklanych kalibrowanych do wlewu?
Zestaw do filtracji pod obniżonym ciśnieniem powinien obejmować między innymi
Wybierz spośród wymienionych właściwości tę, która nie dotyczy naczyń kwarcowych.
Zestaw do filtracji nie zawiera
W celu przeprowadzenia opisanego doświadczenia, należy przygotować:
| Opis procesu wydzielenia kwasu acetylosalicylowego z tabletek |
|---|
| Pięć rozgniecionych tabletek aspiryny (polopiryny) umieszcza się w kolbie stożkowej o pojemności 100 ml, dodaje 10 ml etanolu i ogrzewa na łaźni wodnej, aż do momentu rozpadnięcia się tabletek. W roztworze znajduje się kwas acetylosalicylowy, natomiast masa tabletkowa pozostaje w osadzie. Osad ten odsącza się na ogrzanym lejku szklanym zaopatrzonym w sączek karbowany. Do odebiornego przesączu dodaje się 20-30 ml zimnej wody destylowanej. Dodatek wody powoduje wypadanie osadu aspiryny z roztworu (zmniejsza się rozpuszczalność aspiryny w roztworze wodno-alkoholowym). Wydzielone kryształy odsączyć na lejku sitowym i suszyć na powietrzu. |
Aby pobrać dokładnie 20 cm3 próbkę wody do przeprowadzenia analiz, należy zastosować
Aby przygotować zestaw do filtracji, należy zebrać
Do narzędzi pomiarowych zalicza się
Wskaź zestaw reagentów oraz przyrządów wymaganych do przygotowania 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3?
W trakcie pobierania próbek wody, które mają być analizowane pod kątem składników podatnych na rozkład fotochemiczny, należy
Jakie środki należy zastosować do gaszenia pożaru metali, takich jak magnez, sód czy potas?
Aby przygotować miano kwasu solnego, konieczne jest odważenie węglanu sodu o masie wynoszącej około 400 mg. Jaką precyzję powinna mieć waga używana do odważenia węglanu sodu?
Na ilustracji numery rzymskie wskazują
Aby uzyskać roztwór AgNO3 (masa molowa AgNO3 to 169,8 g/mol) o stężeniu 0,1 mol/dm3, należy rozpuścić w wodzie destylowanej i dopełnić kolbę wodą destylowaną do zaznaczonej kreski.
Średnia masa wody wypływająca z pipety o deklarowanej pojemności 25 cm3, w temperaturze 25°C wynosi 24,80 g. Korzystając z danych zamieszczonych w tabeli wskaż wartość poprawki kalibracyjnej dla tej pipety.
| Masa wody zajmującej objętość 1 dm3 w zależności od temperatury pomiaru | |
|---|---|
| Temperatura °C | Masa wody g |
| 20 | 997,17 |
| 21 | 997,00 |
| 22 | 996,80 |
| 23 | 996,59 |
| 24 | 996,38 |
| 25 | 996,16 |
| 26 | 995,93 |
| 27 | 995,69 |
| 28 | 995,45 |
| 29 | 995,18 |
| 30 | 994,92 |
Nie należy podgrzewać cieczy w szczelnie zamkniętych pojemnikach, ponieważ
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
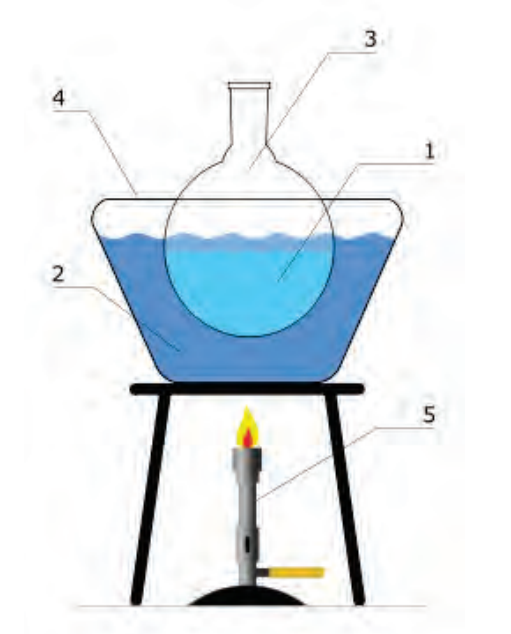
Aby podnieść temperaturę roztworu do 330 K, jakie wyposażenie jest potrzebne?
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
Jak nazywa się naczynie o płaskim dnie, które wykorzystuje się do pozyskiwania substancji stałej poprzez stopniowe odparowanie rozpuszczalnika z roztworu?
Przy przygotowywaniu 100 cm3 roztworu o określonym stężeniu procentowym (m/V) konieczne jest odważenie wyliczonej ilości substancji, a następnie przeniesienie jej do
Które z poniższych działań należy wykonać przed rozpoczęciem pracy z nowym szkłem laboratoryjnym?