Pytanie 1
Którym skrótem oznacza się tomografię komputerową wysokiej rozdzielczości?
Wynik: 29/40 punktów (72,5%)
Wymagane minimum: 20 punktów (50%)
Którym skrótem oznacza się tomografię komputerową wysokiej rozdzielczości?
Osłony na gonady dla osób dorosłych powinny posiadać równoważnik osłabienia promieniowania nie mniejszy niż
Na obrazie uwidoczniono złamanie kompresyjne kręgu
Wysoką rozdzielczość przestrzenną obrazowania MR uzyskuje się przez
W radiografii mianem SID określa się
W celu oceny wieku kostnego u dziecka praworęcznego, wykonuje się pojedyncze zdjęcie w projekcji
Audiometria impedancyjna polega na pomiarze
Jak przebiega promień centralny w projekcji AP czaszki?
Dawka graniczna wyrażona jako dawka skuteczna (efektywna), dla osób zawodowo narażonych na działanie promieniowania jonizującego wynosi w ciągu roku kalendarzowego
Który materiał światłoczuły należy zastosować w rentgenodiagnostyce analogowej, by zminimalizować dawkę promieniowania jonizującego otrzymaną przez pacjenta?
Nieostrość geometryczna obrazu rentgenowskiego zależy od
W scyntygrafii dynamiczne badanie najczęściej rozpoczyna się
Glukoza podawana pacjentowi w badaniu PET jest znakowana radioaktywnym
W technice napromieniania SSD mierzona jest odległość źródła promieniowania
Którą ochronę radiologiczną należy zastosować podczas wykonywania zdjęcia rentgenowskiego przeglądowego klatki piersiowej u pacjentki w okresie rozrodczym?
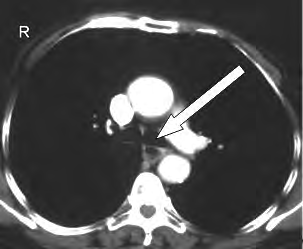
Na obrazie TK klatki piersiowej w przekroju poprzecznym strzałką oznaczono
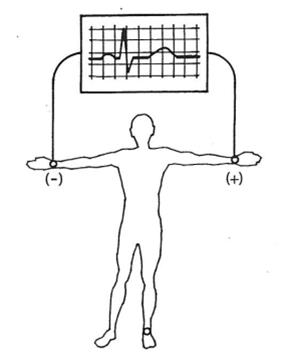
W badaniu EKG elektrodę przedsercową V4 należy umocować
Zgodnie ze standardami do wykonania zdjęcia bocznego czaszki, należy zastosować kasetę o wymiarze
Do wykonania stomatologicznego zdjęcia rentgenowskiego techniką kąta prostego promień centralny należy ustawić prostopadle do
Do podstawowych projekcji stosowanych w diagnostyce mammograficznej należą
Jakie są wielkości mocy dawki stosowanej w brachyterapii HDR?
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
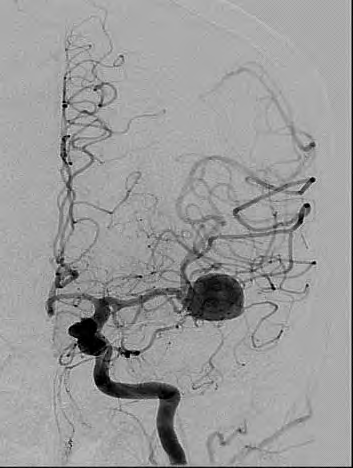
Którą patologię uwidoczniono w badaniu angiograficznym?
Powierzchnia gabinetu rentgenowskiego, w którym zainstalowany jest aparat rentgenowski wyposażony w oddzielną lampę, nie może być mniejsza niż
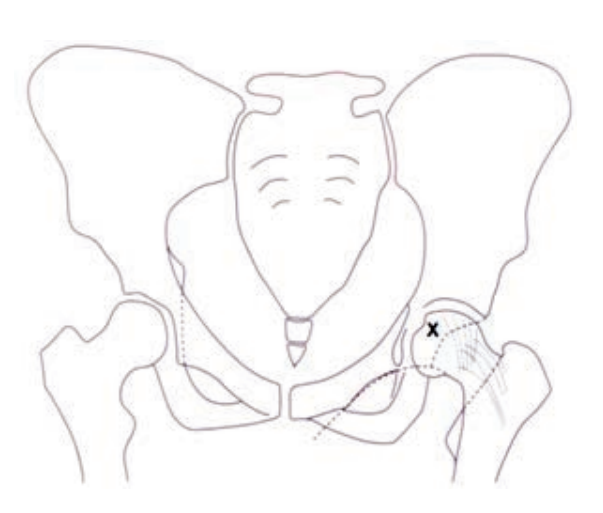
Na rycinie rentgenogramu w projekcji AP symbolem X oznaczono
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
W leczeniu izotopowym tarczycy podaje się
W której pozycji wykonuje się zdjęcie jamy brzusznej u pacjenta z podejrzeniem perforacji żołądka?
W ułożeniu do rentgenografii AP stawu kolanowego promień główny pada
W badaniu EKG elektrodę przedsercową V4 należy umocować
Skrótem HRCT (High Resolution Computed Tomography) określa się tomografię komputerową
Wskaż roczną dawkę graniczną dla osób zatrudnionych w warunkach narażenia na promieniowanie jonizujące.
Które odprowadzenie elektrokardiograficzne przedstawiono na ilustracji?
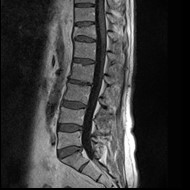
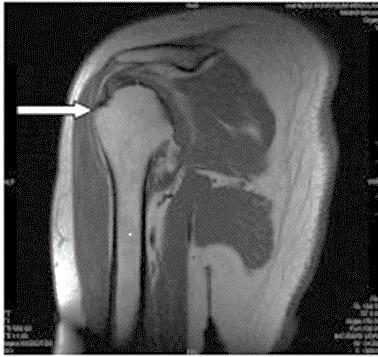
Którą strukturę anatomiczną oznaczono na zamieszczonym obrazie rezonansu magnetycznego?
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
Jaki kolor ma warstwa korowa kości w badaniu MR na obrazie T1- zależnym?
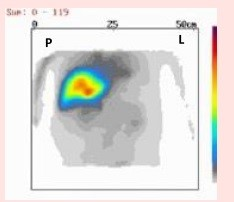
Który narząd został uwidoczniony na przedstawionym obrazie scyntygraficznym?
Zastosowana w badaniu radiologicznym kratka przeciwrozproszeniowa powoduje
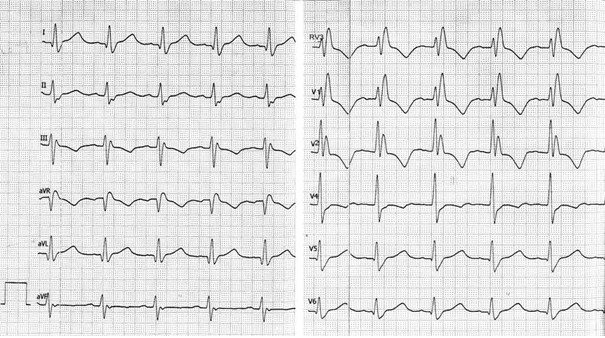
Przedstawiony zapis elektrokardiograficzny może wskazywać na
Zgodnie z procedurą wzorcową w badaniu MR należy ułożyć pacjenta na brzuchu do diagnostyki