Pytanie 1
Jednym z kroków w procesie przygotowania preparatu mikrobiologicznego w stanie żywym jest
Wynik: 34/40 punktów (85,0%)
Wymagane minimum: 20 punktów (50%)
Jednym z kroków w procesie przygotowania preparatu mikrobiologicznego w stanie żywym jest
W celu przeprowadzenia bezpośredniego testu ELISA należy postąpić zgodnie z procedurą

Jak nazywana jest technika analityczna, która polega na pomiarze przewodnictwa roztworu umieszczonego pomiędzy dwiema elektrodami, do których doprowadzany jest prąd przemienny?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
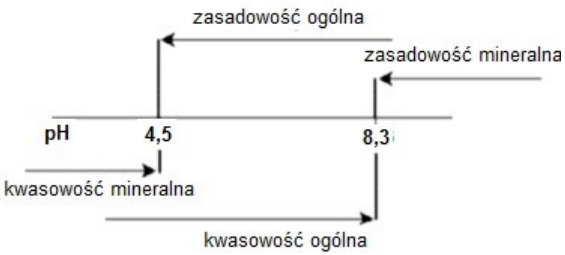
Na schemacie przedstawiono parametry jakości wód. Dla wody o pH = 8,5 należy wykonać badanie
Aby określić wartość absorbancji substancji X, zmierzono, przy tych samych długościach fali, absorbancję mieszaniny X i Y oraz osobno substancji Y.
Jeśli AX+Y = 0,84, a AY = 0,56, to jaka jest wartość AX?
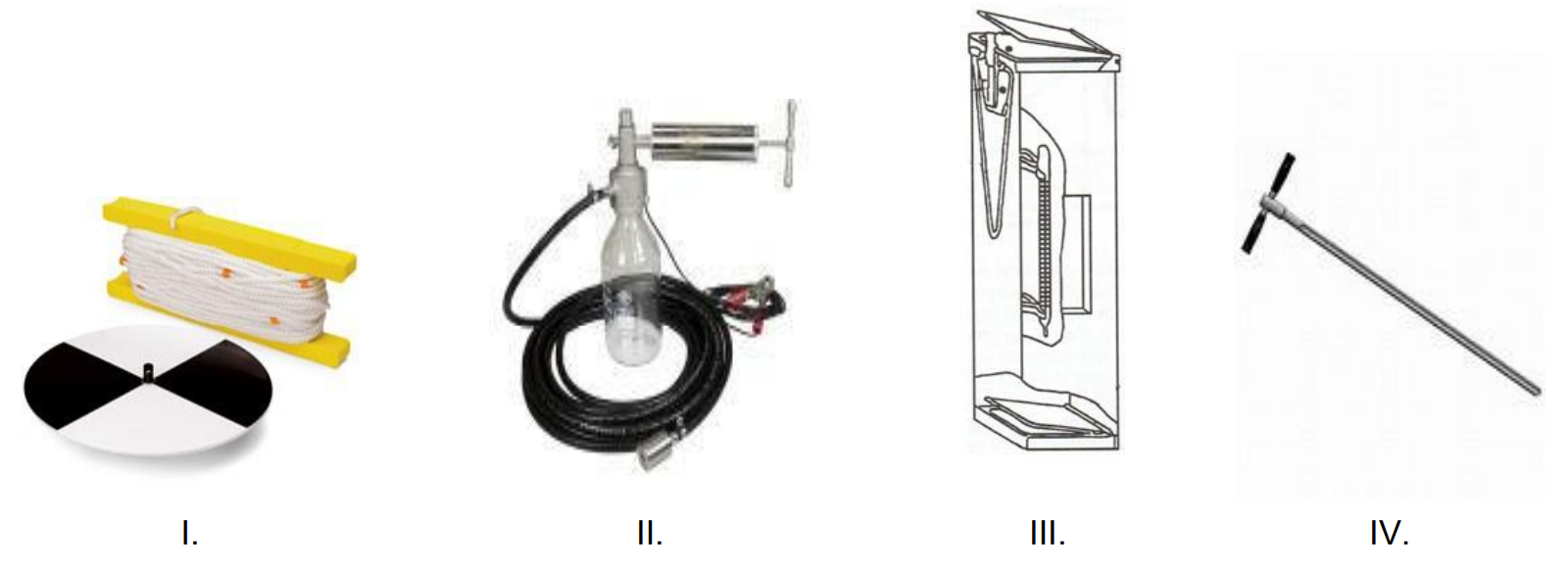
Na którym rysunku przedstawiono sprzęt stosowany do pomiaru mętności wody?
Jakie zjawisko fizyczne stanowi podstawę nefelometrii?
Właściwością jakościową produktów technologicznych jest
BZT5 to umowny wskaźnik wskazujący na biochemiczne zapotrzebowanie na
Zjawisko dzielenia się składników mieszaniny pomiędzy fazę stacjonarną a ruchomą w układzie to proces widoczny w
Lakmus to wskaźnik pH, który w roztworze zasadowym zmienia kolor na
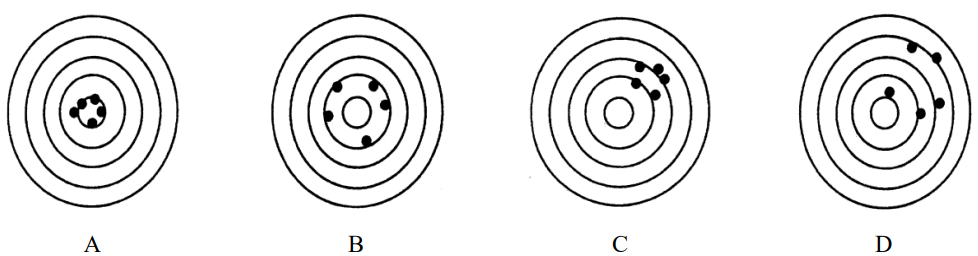
Na rysunkach przedstawiono serie pomiarów o różnej dokładności i precyzji (środek najmniejszego okręgu oznacza wartość prawdziwą). Serię pomiarów nieprecyzyjnych, ale dokładnych, przedstawiono na rysunku
Jakie jest odpowiednie wskaźnik w kompleksometrycznym oznaczaniu magnezu?
Na podstawie danych zawartych w tabeli, wskaż zestaw substancji uporządkowanych według rosnącej temperatury topnienia.
| Substancja | pirydyna | benzen | etanol |
|---|---|---|---|
| Temperatura wrzenia [°C] | 115,5 | 80,1 | 78,3 |
| Temperatura topnienia [°C] | -41,6 | 5,5 | -114,1 |
Ogólna twardość próbki wody stosowanej w technologiach wynosi 16,5°n, a twardość węglanowa osiąga 7,2°n. Jaką wartość ma twardość stała?
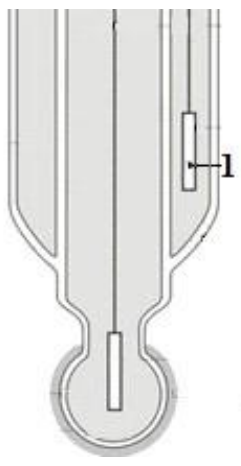
Na rysunku przedstawiono schemat szklanej elektrody zespolonej. Cyfrą 1 oznaczono
W mikrobiologii metoda sterylizacji przy użyciu suchego, gorącego powietrza zalicza się do
W opisie przeprowadzonego eksperymentu
(...) obecność węgla wykrywa się poprzez spalenie próbki i określenie ilości CO2 przy użyciu roztworu wody barytowej. Azot w trakcie spalania próbki z sodem metalicznym generuje cyjanek, który może być wykryty po dodaniu FeSO4 jako błękit pruski (...) Jakiego rodzaju analizę zastosowano w opisywanym doświadczeniu?
Na podstawie danych zamieszczonych w tabeli określ zależność lepkości cieczy od temperatury.
| Ciecz | Lepkość [Pa×s×10-3] | |||
|---|---|---|---|---|
| 0°C | 10°C | 30°C | 60°C | |
| Aceton | 0,397 | 0,361 | 0,296 | 0,228 |
| Toluen | 0,700 | 0,667 | 0,517 | 0,381 |
| Woda | 1,792 | 1,308 | 0,801 | 0,469 |
Proces stapiania substancji z perłą fosforanową lub boraksową realizuje się
Ze względu na zmieniającą się podczas miareczkowania objętość badanego roztworu, należy obliczyć poprawkę p w przypadku miareczkowania
| p = Vpróbki + Vwody + Vtitrantu Vpróbki + Vwody |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Równanie iloczynu rozpuszczalności związku Ca₃(PO₄)₂, który jest trudno rozpuszczalny, opisuje się następująco:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Krzywa na rysunku obrazuje miareczkowanie

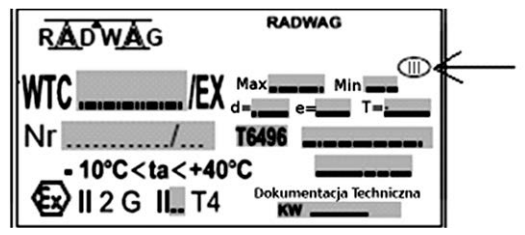
Strzałka zamieszczona na rysunku, przedstawiającym tabliczkę znamionową wagi, wskazuje na
Część opisu skutków analizy
(...) generuje kation jednowartościowy, a sole powstałe z tym kationem to w przeważającej mierze substancje trudnorozpuszczalne. Większość jego soli jest bezbarwna. Ten bezbarwny jon ma zdolność do tworzenia jonów kompleksowych, na przykład z tiosiarczanem sodowym. Związki tego kationu są wrażliwe na światło (ciemnieją pod jego działaniem), dlatego powinny być przechowywane w pojemnikach z ciemnego szkła (...) Z opisu wynika, że w analizowanym surowcu jakościowo oznaczano kation
W tabeli przedstawiono charakterystykę
| Charakterystyka wybranych metod optycznych stosowanych w analizie instrumentalnej | ||
|---|---|---|
| Metoda | Obserwowane zjawisko | Pomiar |
| 1 | załamanie światła | współczynnik załamania światła padającego na powierzchnię próbki |
| 2 | skręcanie płaszczyzny światła spolaryzowanego | kąt skręcenia płaszczyzny polaryzacji światła |
| 3 | rozproszenie promieniowania | natężenie wiązki światła rozproszonego wychodzącego z kuwety pomiarowej |
Który zestaw kationów zawiera kationy reagujące z roztworem (NH4)2C03 w obecności wodnego roztworu amoniaku i w wyniku tych reakcji wytrącają się białe osady?
| A. | B2+, Sr2+, Ca2+ |
| B. | Mg2+, Na+, K+ |
| C. | Fe3+, Al3+, Cr3+ |
| D. | Ag+, H22+, Pb2+ |
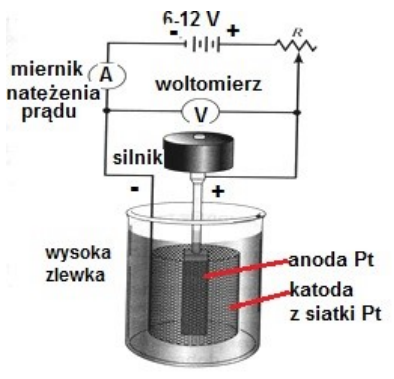
Na schemacie przedstawiono zestaw do
Wzrost dyfuzyjny bakterii w hodowli płynnej przedstawia probówka oznaczona na rysunku jako

Jaką metodę analizy ilościowej wykorzystuje się do oznaczania stężenia nadtlenku wodoru w 3% roztworze wody utlenionej?
W dwóch niezidentyfikowanych probówkach znajdują się roztwory: w jednej - glukozy, a w drugiej - sacharozy. Jakiego odczynnika należy użyć, aby rozpoznać glukozę?
Urządzenie Orsata jest wykorzystywane do pomiaru
Aby przygotować podłoże do badań mikrobiologicznych, należy
Elektroforeza to technika wykorzystywana głównie do segregacji mieszaniny
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
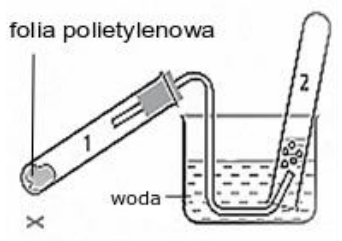
W wyniku przeprowadzenia doświadczenia zgodnie ze schematem, w probówce 2 otrzymano
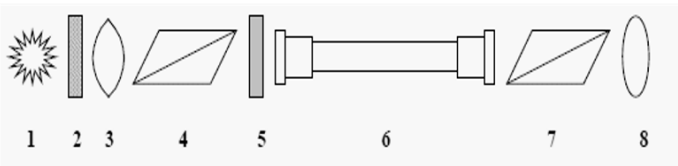
Na rysunku przedstawiającym schemat polarymetru, cyfrą 4 oznaczono