Pytanie 1
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
Wynik: 26/40 punktów (65,0%)
Wymagane minimum: 20 punktów (50%)
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
Który system informatyczny służy do archiwizacji i transmisji obrazów radiologicznych?
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
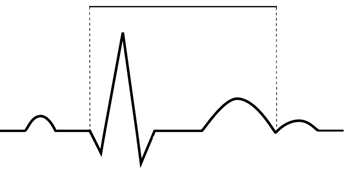
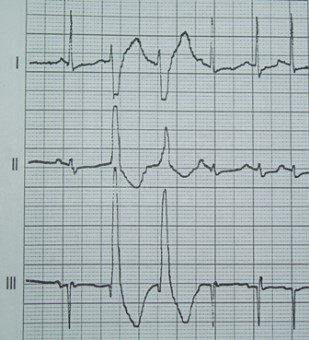
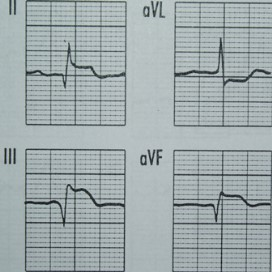
Na wykresie EKG zaznaczono
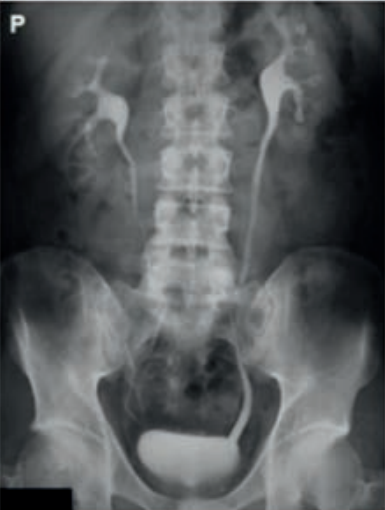
Urografia polega na
Do podstawowych projekcji stosowanych w diagnostyce mammograficznej należą
W radiologii stomatologicznej ząb o numerze 23 to kieł
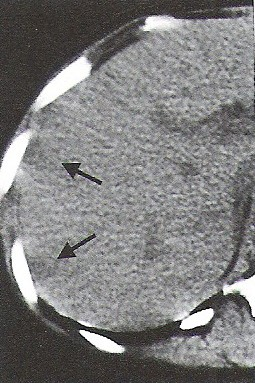
Na którym obrazie TK uwidoczniony jest artefakt spowodowany ruchami oddechowymi pacjenta?

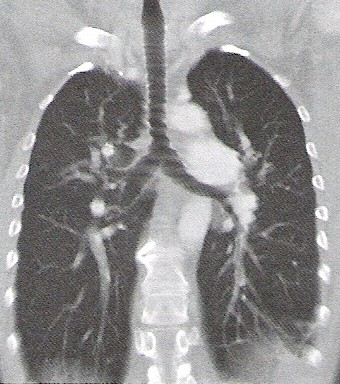
Na rentgenogramie uwidoczniono badanie
Który środek kontrastujący stosuje się w badaniu metodą rezonansu magnetycznego?
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
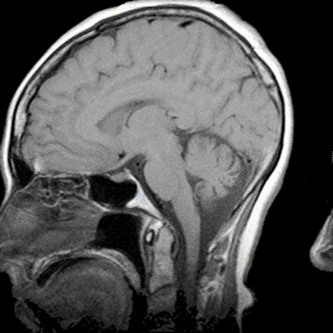
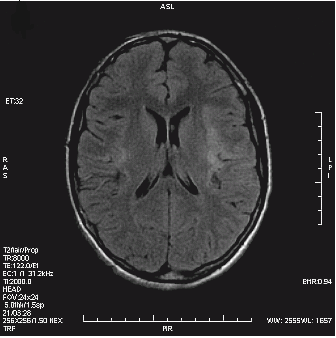
Który artefakt uwidoczniono na skanie RM głowy?
Do wykonania stomatologicznego zdjęcia rentgenowskiego techniką kąta prostego promień centralny należy ustawić prostopadle do
Osłony na gonady dla osób dorosłych powinny posiadać równoważnik osłabienia promieniowania nie mniejszy niż
Rozpraszanie promieniowania X, w wyniku którego następuje zwiększenie długości fali promieniowania, to zjawisko
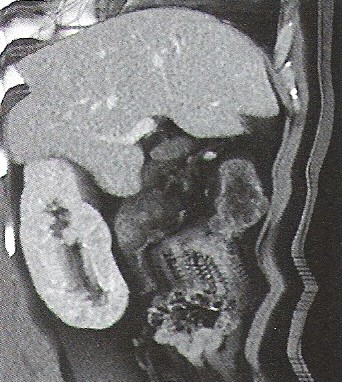
Zamieszczone obrazy związane są z badaniem
W której próbie stroikowej przystawia się stroik do czoła (u podstawy nosa) lub na szczycie głowy i porównuje się przewodnictwo kostne ucha prawego i lewego?
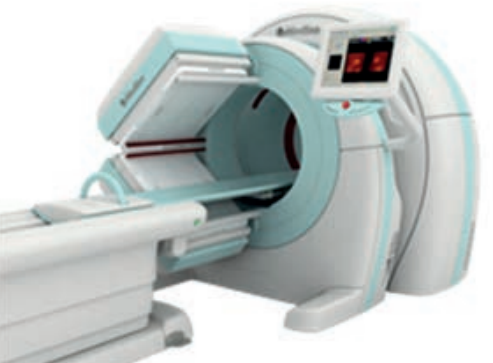
Które urządzenie zostało przedstawione na fotografii i w jakiej pracowni znajduje zastosowanie?
Co jest przyczyną artefaktu widocznego na obrazie MR?
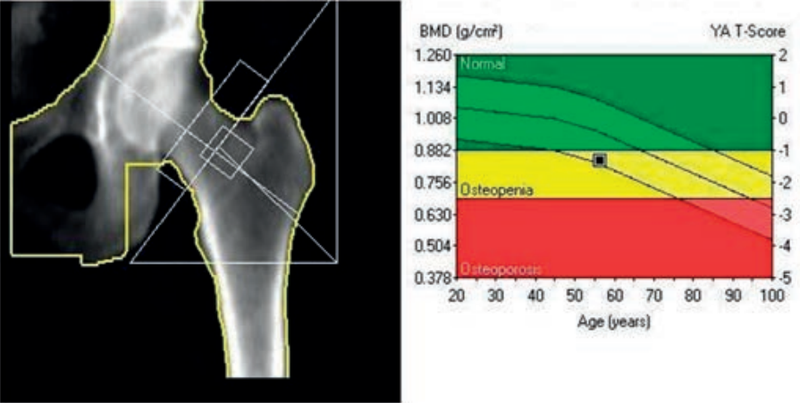
Warstwa półchłonna (WP) jest wyrażona w mm Cu dla
Co określa M₀ w systemie klasyfikacji nowotworów TNM?
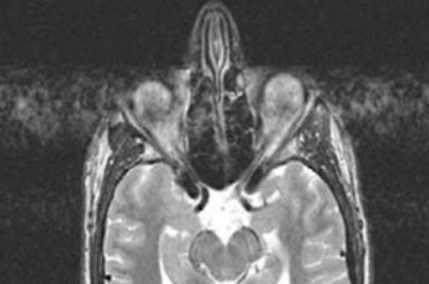
Na przekroju poprzecznym rezonansu magnetycznego strzałką oznaczono
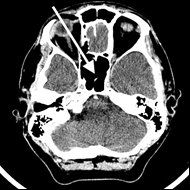
Na przekroju poprzecznym TK mózgu strzałką wskazano obszar
Wysoką rozdzielczość przestrzenną obrazowania MR uzyskuje się przez
Zwiększenie napięcia na lampie rentgenowskiej powoduje
Do zdjęcia prawych otworów międzykręgowych kręgosłupa szyjnego pacjent stoi w skosie
Wysoką rozdzielczość przestrzenną obrazowania MR uzyskuje się przez
Jaki jest cel stosowania bolusa w radioterapii?
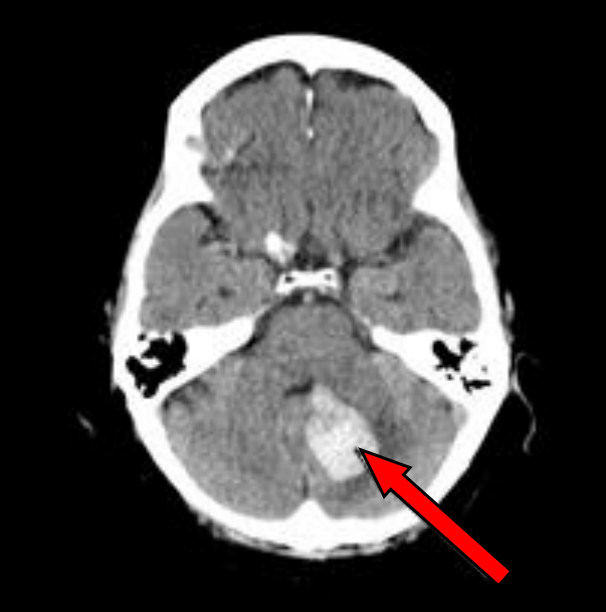
Na radiogramie TK głowy strzałką wskazano
Które środki kontrastujące wykorzystywane są w diagnostyce rezonansem magnetycznym?
Do zdjęcia rentgenowskiego żeber w projekcji skośnej tylnej pacjenta należy ustawić
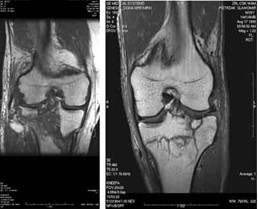
Którą metodą i w której płaszczyźnie zostało wykonane badanie stawu kolanowego zobrazowane na zdjęciach?
Badanie cewki moczowej polegające na wstecznym wprowadzeniu środka kontrastowego to
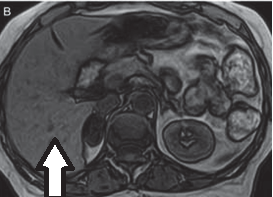
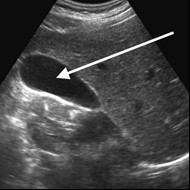
Na obrazie ultrasonograficznym jamy brzusznej strzałką wskazano
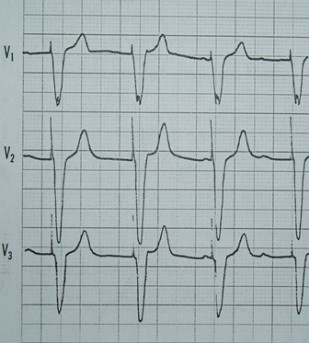
Na którym z zapisów EKG została uwidoczniona fala Pardee'go?
Rytm alfa i beta rejestruje się podczas badania
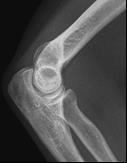
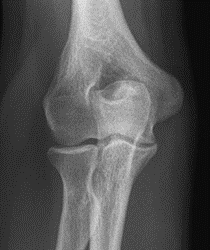
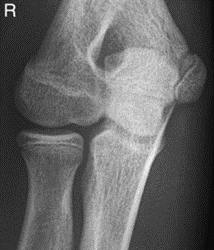
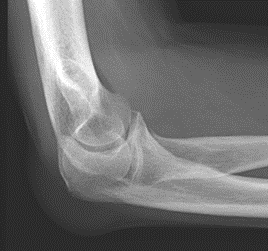
Które zdjęcie RTG stawu łokciowego zostało wykonane w projekcji skośnej w rotacji zewnętrznej?
W obrazowaniu MR do uwidocznienia naczyń krwionośnych jest stosowana sekwencja
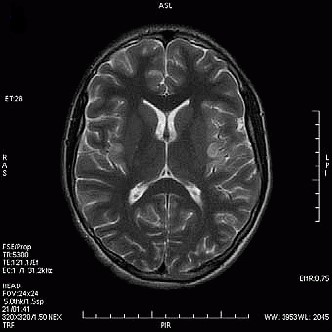
Który obraz MR mózgu został wykonany w sekwencji DWI?
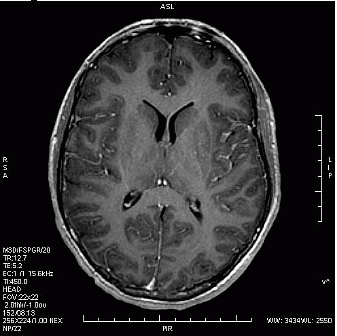
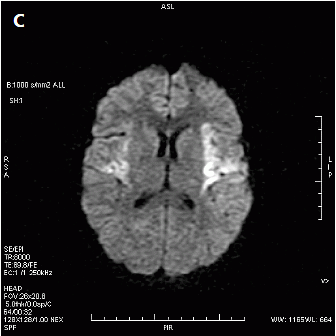
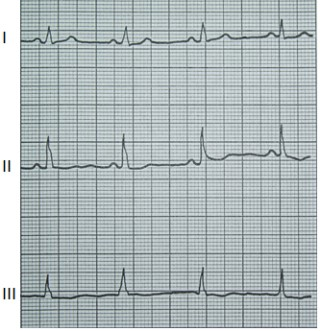
W badaniu EKG różnice potencjałów pomiędzy lewym podudziem a lewym przedramieniem rejestruje odprowadzenie