Pytanie 1
Na rysunku przedstawiono urządzenie służące do poboru próbek

Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
Na rysunku przedstawiono urządzenie służące do poboru próbek

To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Gęstość cieczy w próbce określa się bezpośrednio za pomocą
Intensywna reakcja z FeCl3 jest wykorzystywana do identyfikacji
Ustalanie miana roztworu polega na
300 cm3 zanieczyszczonego benzenu poddano procesowi destylacji. Uzyskano 270 cm3 czystej substancji. Jaką wydajność miało oczyszczanie?
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
Aby przygotować 150 g roztworu jodku potasu o stężeniu 10% (m/m), konieczne jest użycie
(zakładając, że gęstość wody wynosi 1 g/cm3)
Ile gramów chlorku baru powinno się rozpuścić w wodzie, aby uzyskać 200 cm3 roztworu o stężeniu 10% i gęstości 1,203 g/cm3?
Związek o podanym wzorze to kwas
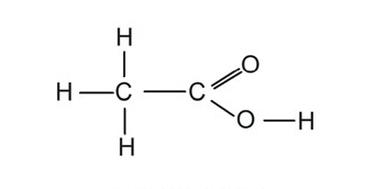
W celu uzyskania 500 g mieszaniny oziębiającej o temperaturze -18oC należy zmieszać
| Tabela. Mieszaniny oziębiające | ||
|---|---|---|
| Temperatura mieszaniny [°C] | Skład mieszaniny | Stosunek masowy |
| -2 | Woda + chlorek amonu | 10 : 3 |
| -15 | Woda + rodanek amonu | 10 : 13 |
| -18 | Lód + chlorek amonu | 10 : 3 |
| -21 | Lód + chlorek sodu | 3 : 1 |
| -22 | Lód + chlorek amonu + azotan(V) amonu | 25 : 5 : 11 |
| -25 | Lód + azotan(V) amonu | 1 : 1 |
Na podstawie danych w tabeli wskaż, którego środka suszącego można użyć do osuszenia związku o wzorze (CH3)2CO
| Środek suszący | Stosowany do suszenia | Nie nadaje się do suszenia |
|---|---|---|
| Na | Eter, węglowodory, aminy trzeciorzędowe | Chlorowcopochodne węglowodorów |
| CaCl₂ | Węglowodory, aceton, eter, gazy obojętne | Alkohole, amoniak, aminy |
| Żel krzemionkowy | W eksykatorze | HF |
| H₂SO₄ | Gazy obojętne i kwasowe | Związki nienasycone, alkohole, substancje zasadowe |
Proces oddzielania cieczy od osadu nazywa się
Z uwagi na bezpieczeństwo pracy, ciecze żrące powinny być podgrzewane w łaźniach
Którego z poniższych naczyń laboratoryjnych nie powinno się używać do podgrzania 100 cm3wody?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Ogrzewanie organicznych substancji w atmosferze powietrza w otwartym naczyniu, mające na celu przemianę tych substancji w związki nieorganiczne, określa się jako mineralizacja?
Jakie oznaczenie znajduje się na naczyniach szklanych kalibrowanych do wlewu?
Którego odczynnika należy użyć do przygotowania roztworu wzorcowego, zawierającego jony \( \text{Fe}^{3+} \)?
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
Wody pobrane ze studni powinny być przewożone w szczelnie zamkniętych butelkach z przezroczystego materiału
Jakie jest stężenie molowe roztworu, jeśli w 100 cm3 roztworu znajduje się 5,6 g KOH?
MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol
Roztwór zawierający 16,00 g siarczanu(VI) miedzi(II) nasycono siarkowodorem. Masa wytrąconego siarczku miedzi(II), po odsączeniu i wysuszeniu, wynosiła 8,64 g. Oblicz procentową wydajność tej reakcji.
Równanie reakcji:
\( \text{CuSO}_4 + \text{H}_2\text{S} \rightarrow \text{CuS} + \text{H}_2\text{SO}_4 \)
\( \text{M CuSO}_4 = 160 \, \text{g/mol} \)
\( \text{M CuS} = 96 \, \text{g/mol} \)
Do reakcji estryfikacji użyto 150 g kwasu benzoesowego (M = 122,12 g/mol), w wyniku której otrzymano czysty preparat benzoesanu metylu (M = 136,2 g/mol). Ile gramów benzoesanu metylu otrzymano, jeżeli reakcja przebiegała z wydajnością 92%?
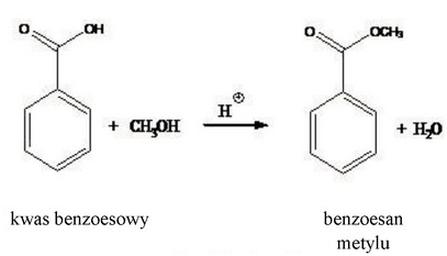
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Pierwotna próbka jest zbierana
Zestaw do filtracji nie zawiera
Podaj nazwę reagentu chemicznego, który w specyficznych warunkach reaguje tylko z jednym jonem, pierwiastkiem lub związkiem chemicznym?
Przyrząd przedstawiony na rysunku służy do pobierania próbek substancji
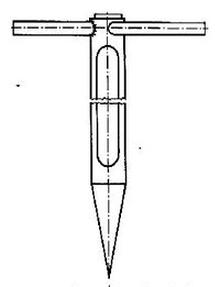
Czy próbkę laboratoryjną przechowuje się w lodówce, gdy występuje w niej
Wykorzystując pipetę gazową, pobrano próbkę azotu (Mn2 = 28 g/mol) o objętości 250 cm3 w standardowych warunkach. Jaką masę ma zmierzony azot?
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |
Osoba pracująca z lotnym rozpuszczalnikiem straciła przytomność. Jakie działania należy podjąć, aby udzielić pierwszej pomocy?
Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych.
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Oznaczenie | Sposób utrwalania i przechowywania |
|---|---|
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO3 |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1- 2 z użyciem H2SO4 |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO3 |
| Żelazo | pH 1-2 z użyciem HNO3 |
| Utlenialność | pH1-2 z użyciem H2SO4, Przechowywać w ciemności |
Symbol "In" znajduje się na
Działanie podejmowane po pobraniu próbki wody, mające na celu zachowanie jej składu chemicznego podczas transportu, określa się mianem
Jaką masę siarczanu(VI) miedzi(II)-woda(1/5) należy poddać suszeniu, aby otrzymać 300 g soli bezwodnej?
| CuSO4 · 5H2O → CuSO4 + 5H2O |
| (MCuSO4·5H2O = 249,5 g/mol, MCuSO4 = 159,5 g/mol, MH2O = 18,0 g/mol) |
W tabeli zamieszczono temperatury wrzenia niektórych składników powietrza. Na podstawie tych danych podaj, który ze składników oddestyluje jako ostatni.
| Temperatura wrzenia °C | Składniki |
|---|---|
| -245,9 | Neon |
| -182,96 | Tlen |
| -195,8 | Azot |
| -185,7 | Argon |
Przedstawiony na ilustracji zestaw służy do

Które z poniższych równań ilustruje reakcję, w której powstają produkty gazowe?