Pytanie 1
Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
Wynik: 23/40 punktów (57,5%)
Wymagane minimum: 20 punktów (50%)
Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
Aby podnieść stężenie mikroelementów w roztworze, próbkę należy poddać
W wypadku oblania skóry kwasem mrówkowym należy
| Wyciąg z karty charakterystyki Skład: kwas mrówkowy 80%, woda 11-20% Pierwsza pomoc. Po narażeniu przez drogi oddechowe. Natychmiast wezwać lekarza. Po kontakcie ze skórą. Zanieczyszczoną skórę natychmiast przemyć dużą ilością wody. |
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Zjawisko fizyczne, które polega na rozkładaniu struktury krystalicznej substancji stałej oraz przenikaniu jej cząsteczek lub jonów do cieczy, nosi nazwę
Na etykiecie próbki środowiskowej należy umieścić datę jej pobrania, lokalizację poboru oraz
Odlanie cieczy z nad osadu to
W przypadku odczynnika, w którym nawet najczulsze techniki analizy chemicznej nie są w stanie wykryć zanieczyszczeń, a jego badanie wymaga zastosowania metod opartych na zjawiskach fizycznych, zalicza się on do kategorii czystości
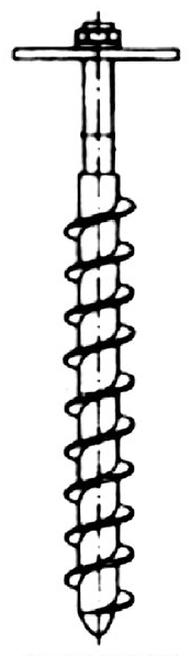
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
250 cm3 roztworu kwasu octowego o stężeniu 10% objętościowych zostało rozcieńczone pięciokrotnie. Jakie jest stężenie otrzymanego roztworu?
Z przedstawionego opisu wynika, że kluczową właściwością próbki analitycznej jest jej
Próbka analityczna to fragment materiału stworzony z myślą o przeprowadzeniu badania lub obserwacji. Powinna odzwierciedlać przeciętny skład i cechy materiału, który jest badany.
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Reakcja neutralizacji wodorotlenku sodu z kwasem solnym zrealizowana jest zgodnie z równaniem:
NaOH + HCl → NaCl + H2O Masy molowe: MNaOH = 40 g/mol, MHCl = 36,5 g/mol Aby zneutralizować 10 g wodorotlenku sodu, wymagane jest
Z uwagi na bezpieczeństwo pracy, ciecze żrące powinny być podgrzewane w łaźniach
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Podczas przewozu próbek wody, które mają być badane pod kątem właściwości fizykochemicznych, zaleca się, aby te próbki były
Wskaż metodę rozdzielenia układu, w którym fazą rozproszoną jest ciało stałe, a fazą rozpraszającą gaz.
| faza rozproszona | faza rozpraszająca | ||
|---|---|---|---|
| gaz | ciecz | ciało stałe | |
| gaz | - | piana | piana stała |
| ciecz | aerozol ciekły | emulsja | emulsja stała |
| ciało stałe | aerozol stały | zol | zol stały |
Piknometr służy do określania
Na rysunku przedstawiono wagę

Na rysunku pokazano przyrząd do poboru próbek
Oblicz stężenie molowe 250 cm3 roztworu NaOH, w którym znajduje się 0,5 g substancji. Masa molowa NaOH wynosi 40 g/mol
Działanie podejmowane po pobraniu próbki wody, mające na celu zachowanie jej składu chemicznego podczas transportu, określa się mianem
Które z wymienionych reakcji chemicznych stanowi reakcję redoks?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przedstawiony schemat ideowy ilustruje proces wytwarzania N2 → NO → NO2 → HNO3
Jaką metodę poboru próbek przedstawiono na rysunku?

Czy próbkę laboratoryjną przechowuje się w lodówce, gdy występuje w niej
Metoda oczyszczania substancji, która opiera się na różnicy w rozpuszczalności substancji docelowej oraz zanieczyszczeń w zastosowanym rozpuszczalniku, nosi nazwę
Procedura oznaczenia kwasowości mleka. Do wykonania analizy, zgodnie z powyższą procedurą, potrzebne są
| Do kolby stożkowej o pojemności 300 cm3 pobrać dokładnie 25 cm3 badanego mleka i rozcieńczyć wodą destylowaną do objętości 50 cm3. Dodać 2-3 krople fenoloftaleiny i miareczkować mianowanym roztworem wodorotlenku sodu do uzyskania lekko różowego zabarwienia. |
Dokonano pomiaru pH dwóch roztworów, uzyskując wartości pH= 2 oraz pH= 5. Wskaźnij poprawnie sformułowany wniosek.
Po rozpuszczeniu substancji w kolbie miarowej, należy odczekać przed dopełnieniem jej wodą "do kreski" miarowej. Taki sposób postępowania jest uzasadniony
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Określ, jakie informacje powinny być zarejestrowane w ewidencji wydania substancji niebezpiecznych, stosowanych w badaniach laboratoryjnych?
Eliminacja substancji organicznych z próbki poprzez jej spalenie nazywa się