Pytanie 1
Z 250 g benzenu (M = 78 g/mol) uzyskano 350 g nitrobenzenu (M = 123 g/mol). Jaka jest wydajność reakcji nitrowania?
Wynik: 28/40 punktów (70,0%)
Wymagane minimum: 20 punktów (50%)
Z 250 g benzenu (M = 78 g/mol) uzyskano 350 g nitrobenzenu (M = 123 g/mol). Jaka jest wydajność reakcji nitrowania?
Na podstawie zamieszczonych w tabeli opisów metod rozdzielania mieszanin, dobierz odpowiadające im nazwy.
| Tabela. Metody rozdzielania mieszanin | |
|---|---|
| Lp. | Opis metody |
| I. | Zlewanie cieczy znad osadu. |
| II. | Przeprowadzenie ciekłego rozpuszczalnika w stan pary. |
| III. | Wyodrębnianie z mieszaniny ciał stałych lub cieczy składnika przy pomocy rozpuszczalnika tak dobranego, aby rozpuszczał żądany związek chemiczny. |
| IV. | Powolne opadanie cząstek substancji stałej w cieczy pod wpływem własnego ciężaru. |
Z próbek przygotowuje się ogólną próbkę
Ile węglanu sodu trzeba odmierzyć, aby uzyskać 200 cm3 roztworu o stężeniu 8% (m/v)?
Jakie jest znaczenie skrótu: cz. na etykiecie reagentu chemicznego?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który sposób przechowywania próbek żywności jest niezgodny z Rozporządzeniem Ministra Zdrowia?
| Fragment Rozporządzenia Ministra Zdrowia w sprawie pobierania i przechowywania próbek żywności przez zakłady żywienia zbiorowego typu zamkniętego |
| (...) Zakład przechowuje próbki, przez co najmniej 3 dni, licząc od chwili, kiedy cała partia została spożyta w miejscu wyłącznym właściwym do tego celu oraz w warunkach zapewniających utrzymanie temperatury +4°C lub niższej, w zależności od przechowywanego produktu. Miejsce przechowywania próbek musi być tak zabezpieczone, aby dostęp do niego posiadał tylko kierujący zakładem lub osoba przez niego upoważniona. |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
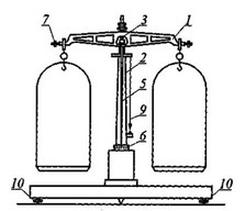
Urządzeniem pomiarowym nie jest
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
Wskaż sprzęt, którego należy użyć, aby przygotować 100 cm3 roztworu NaOH o stężeniu 0,1 mol/dm3.
| 1 | 2 | 3 | 4 | 5 |
| naczynko wagowe | waga analityczna | kolba stożkowa | kolba miarowa pojemności 50 cm3 | kolba miarowa pojemności 100 cm3 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W trakcie pobierania próbek wody, które mają być analizowane pod kątem składników podatnych na rozkład fotochemiczny, należy
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |
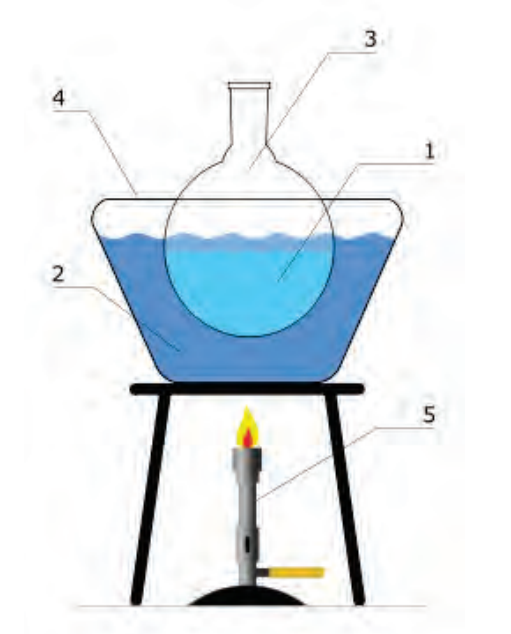
Elementami brakującymi w zestawie przedstawionym na rysunku są
Na skutek krystalizacji 18 g kwasu benzoesowego uzyskano 8 g czystego produktu. Jaką wydajność miała ta krystalizacja?
Przeprowadzono reakcję 13 g cynku z kwasem solnym zgodnie z równaniem: Zn + 2 HCl → ZnCl2 + H2↑. Otrzymano 1,12 dm3 wodoru (w warunkach normalnych). Masy molowe to: MZn = 65 g/mol, MH = 1g/mol, MCl = 35,5g/mol. Jaka jest wydajność tego procesu?
Do kolby destylacyjnej wprowadzono 200 cm3 zanieczyszczonego acetonu o gęstości d = 0,9604 g/cm3 oraz czystości 90% masowych. W celu oczyszczenia przeprowadzono proces destylacji, w wyniku czego uzyskano 113,74 g czystego acetonu. Jakie były straty acetonu podczas destylacji?
Rozpuszczalnik stosowany w procesie krystalizacji powinien
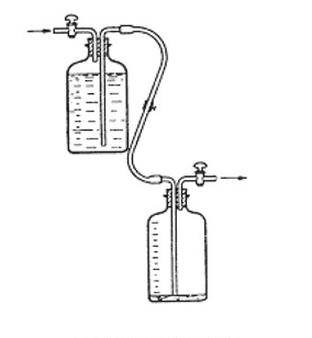
Na rysunku przedstawiono przyrząd do pobierania próbek

Błąd związany z odczytem poziomu cieczy w kolbie miarowej, spowodowany niewłaściwą pozycją oka w stosunku do skali, nazywany jest błędem
W którym wierszu są zapisane nazwy wyłącznie rozpuszczalników palnych?
| Właściwości wybranych rozpuszczalników. | ||||
|---|---|---|---|---|
| Rozpuszczalnik | Gęstość [g/cm3] | Temperatura wrzenia [°C] | Temperatura zapłonu [°C] | Rozpuszczalność w wodzie [g/100 cm3] |
| Eter dietylowy | 0,71 | 35 | -45 | 7 |
| Heksan | 0,66 | 60-80 | -23 | 0,01 |
| Aceton | 0,79 | 57 | -18 | ∞ |
| Benzen | 0,88 | 80 | -11 | 0,07 |
| Chloroform | 1,49 | 61 | - | 0,82 |
| Tetrachlorometan | 1,59 | 77 | - | 0,08 |
| Etanol | 0,81 | 78 | 12 | ∞ |
| Chlorometan | 1,34 | 41 | - | 2 |
Jaką substancję należy koniecznie oddać do utylizacji?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na ilustracji numery rzymskie wskazują
Oddzielanie płynnej mieszaniny wieloskładnikowej poprzez odparowanie, a następnie skraplanie jej komponentów, to proces
W tabeli zamieszczono temperatury wrzenia niektórych składników powietrza. Na podstawie tych danych podaj, który ze składników oddestyluje jako ostatni.
| Temperatura wrzenia °C | Składniki |
|---|---|
| -245,9 | Neon |
| -182,96 | Tlen |
| -195,8 | Azot |
| -185,7 | Argon |
Wybór lokalizacji do poboru próbek wody z rzeki nie jest uzależniony od
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie urządzenie wykorzystuje się do pobierania próbek gazów?
Jakie czynniki wpływają na zmiany jakościowe w składzie próbki?
Podczas pobierania próby wody do oznaczania metali ciężkich zaleca się stosowanie butelek wykonanych z:
Zastosowanie łaźni wodnej nie jest zalecane w trakcie prac, w których stosuje się
Substancje kancerogenne to
Na rysunku przedstawiono
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
Rysunek przedstawia wagę techniczną. Numerem 7 oznaczono