Pytanie 1
Do zadań technika elektroradiologa w pracowni hemodynamicznej należy
Wynik: 37/40 punktów (92,5%)
Wymagane minimum: 20 punktów (50%)
Do zadań technika elektroradiologa w pracowni hemodynamicznej należy
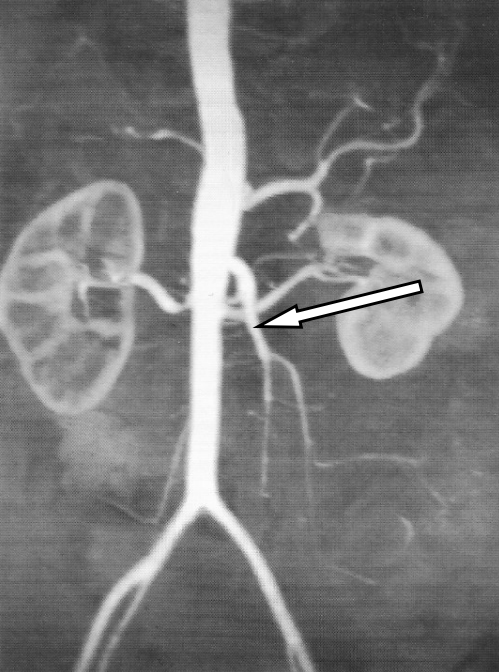
Którą tętnicę zaznaczono strzałką na obrazie MR?
W badaniu cystografii wstępującej środek kontrastowy należy podać
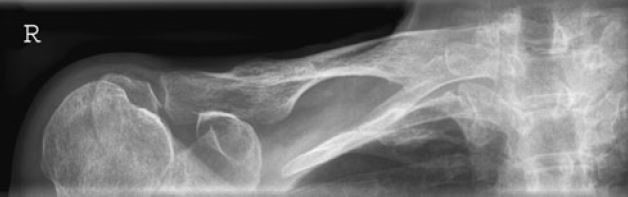
W jakiej projekcji i pod jakim kątem padania promienia centralnego został wykonany radiogram obojczyka?
Obrazowanie w sekwencjach STIR, FLAIR, SE wykonywane jest w badaniu
Jednostką indukcji magnetycznej jest
Jak konwencjonalnie frakcjonuje się dawkę w teleradioterapii?
W których projekcjach wykonuje się standardowe badanie mammograficzne?
Na schemacie oznaczono
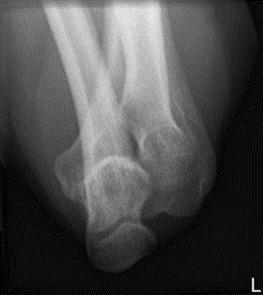
Którą strukturę anatomiczną i w jakiej projekcji uwidoczniono na radiogramie?
W jakich jednostkach mierzy się natężenie dźwięku?
Jaka jest odległość pomiędzy źródłem promieniowania a powierzchnią ciała pacjenta w technice izocentrycznej radioterapii?
Celem radioterapii paliatywnej nie jest
Przy ułożeniu do zdjęcia kręgów szyjnych CIII-CVII w projekcji przednio-tylnej lampa może być odchylona o kąt
Zadaniem technika elektroradiologa w pracowni naczyniowej jest
Który radioizotop jest emiterem promieniowania alfa?
Która struktura może być oknem akustycznym w badaniu ultrasonograficznym?
Przy ułożeniu do zdjęcia AP czaszki płaszczyzna
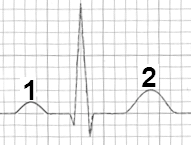
Który załamek odzwierciedla szybką repolaryzację komór w zapisie EKG?
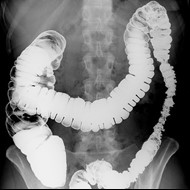
Kolonoskopia to badanie, które ma na celu ocenę błony śluzowej
W standardowym badaniu elektrokardiologicznym elektrodę C4 należy umocować
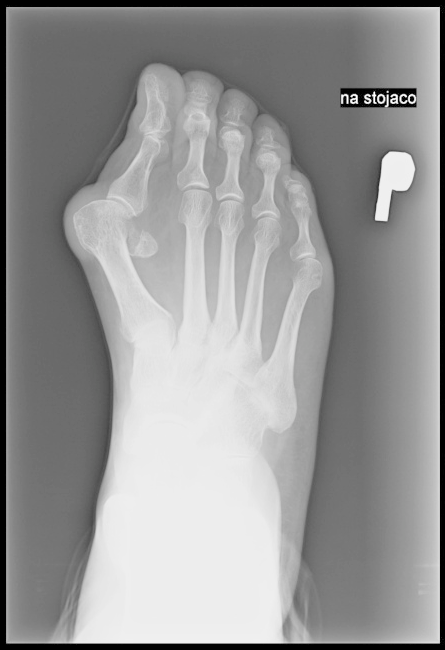
Na radiogramie uwidoczniono
W technice napromieniania SSD mierzona jest odległość źródła promieniowania od
Który załamek w zapisie EKG odpowiada zjawisku depolaryzacji przedsionków mięśnia sercowego?
Parametr SNR w obrazowaniu MR oznacza
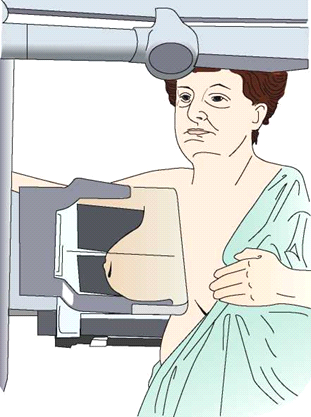
Ilustracja przedstawia pozycjonowanie pacjentki do badania mammograficznego w projekcji
Podczas badania EEG otwarcie oczu powoduje
W badaniu PET stosuje się tylko radioizotopy emitujące
Jaki czas należy ustawić do wykonania zdjęcia rentgenowskiego dwójki górnej lewej?
| Tabela ekspozycji | |||
|---|---|---|---|
| wartości | czasu (s) | napięcia (kV) | natężenia (mA) |
| zęby przedtrzonowe i kły | 0,160 | 60 | 8 |
| siekacze | 0,120 | 60 | 8 |
| zęby trzonowe | 0,200 | 60 | 8 |
| ekspozycja zgryzowo-skrzydełkowa | 0,180 | 66 | 6 |
Jaki rozmiar kasety należy zastosować, wykonując standardowe zdjęcie stawu kolanowego w projekcji bocznej?
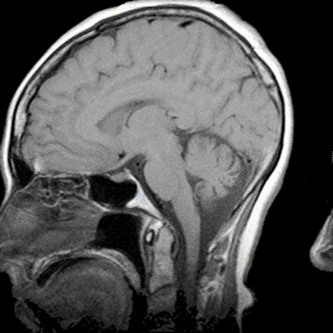
Który artefakt uwidoczniono na skanie RM głowy?
W obrazowaniu metodą rezonansu magnetycznego T1 oznacza czas
Jak przebiega promień centralny w projekcji AP czaszki?
Który narząd został uwidoczniony na przedstawionym obrazie scyntygraficznym?
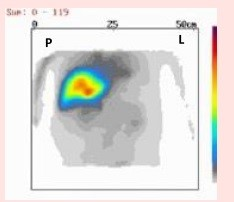
Wskazaniem do wykonania scyntygrafii perfuzyjnej jest
Pojawienie się w zapisie EKG patologicznego załamka Q lub QS może wskazywać na
Największa wartość energii promieniowania stosowanego w radioterapii jest generowana przy użyciu
Czym charakteryzuje się późny odczyn popromienny?
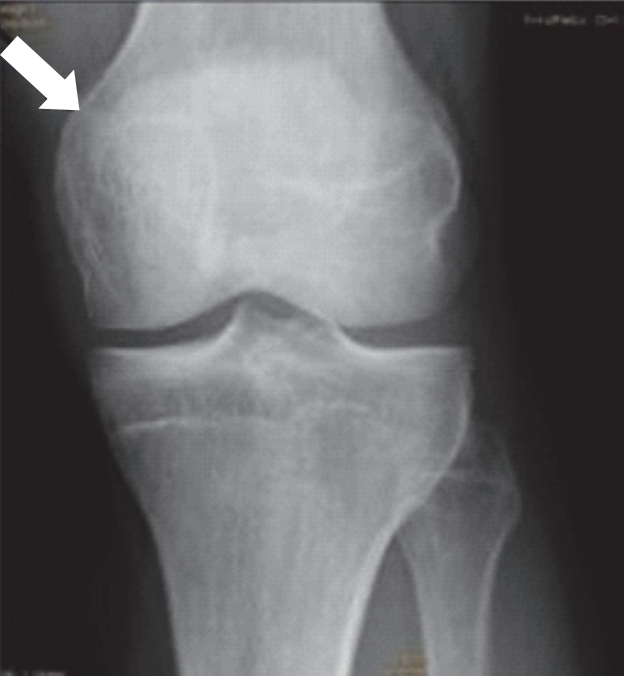
Którą strukturę anatomiczną zaznaczono na radiogramie stawu kolanowego?
Przedstawiony obraz radiologiczny został zarejestrowany podczas badania jelita