Pytanie 1
Jakim urządzeniem mierzy się zasolenie gleby?
Wynik: 31/40 punktów (77,5%)
Wymagane minimum: 20 punktów (50%)
Jakim urządzeniem mierzy się zasolenie gleby?
Metoda Mohra do oznaczania chlorków polega na
W tabeli przedstawiono fragment opisu parametrów
| Zakresy pomiarowe | Przewodnictwo: 0,01 µS/cm÷500 mS/cm Zasolenie: 0,0÷1999 mg/l NaCl 2.0÷50,0 g/l NaCl |
| Błąd pomiaru (± 1 cyfra) | Przewodnictwo ≤ 0,5%, Zasolenie ≤ 0,5%, |
| Temperatura odniesienia | 20 lub 25°C. Ustawienie fabryczne: 25°C |
| Warunki otoczenia | Temperatura pracy: 0°C do 50°C, temperatura przechowywania: -15°C do 65°C, 80% wilgotności względnej (bez kondensacji) |
W celu oceny jakości masła wykonano oznaczenie liczby kwasowej LK, liczby zmydlania LZ i liczby nadtlenkowej LOO. Wyniki zapisano w tabeli. Wartość liczby estrowej LE dla badanego masła wynosi
| Rodzaj liczby | Wartość zmierzona |
|---|---|
| LZ | 196,8 mg KOH/1g |
| LK | 1,2 mg KOH/1g |
| LE | ? |
| LOO | 4,25 milirównoważnika aktywnego tlenu/ kg |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby określić gęstość na podstawie siły wyporu działającej na pływak zanurzony w analizowanej cieczy, należy użyć
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który zestaw kationów zawiera kationy reagujące z roztworem (NH4)2C03 w obecności wodnego roztworu amoniaku i w wyniku tych reakcji wytrącają się białe osady?
| A. | B2+, Sr2+, Ca2+ |
| B. | Mg2+, Na+, K+ |
| C. | Fe3+, Al3+, Cr3+ |
| D. | Ag+, H22+, Pb2+ |
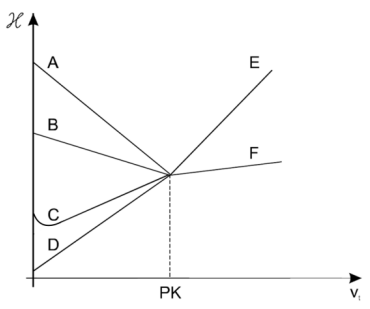
Zawartość kwasu octowego oznaczano alkacymetrycznie, mierząc zmiany przewodnictwa właściwego mieszaniny reakcyjnej w wyniku dodawania roztworu NaOH. Przebieg miareczkowania przedstawiają linie
Jakie jest (w przybliżeniu) stężenie procentowe srebra (M = 107,9 g/mol) w monecie o wadze 0,3200 g, jeśli do jego wykrycia użyto 25,0 cm3 roztworu NH4SCN o stężeniu 0,1000 mol/dm3?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Urządzenie, które umożliwia pomiar gęstości na podstawie masy oraz objętości analizowanej próbki, to
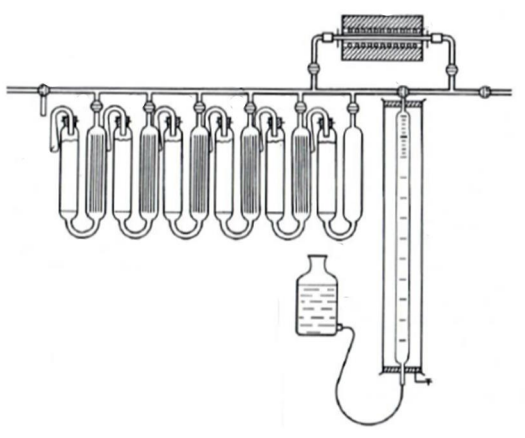
Na rysunku przedstawiono schemat aparatu
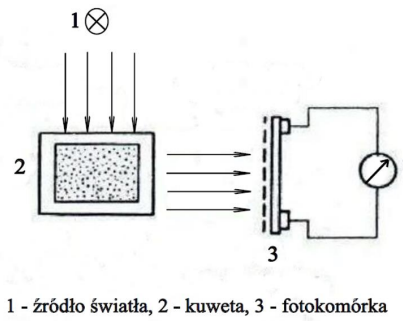
Zjawisko opisane w zamieszczonej informacji to
| Jeżeli w wodzie zostanie rozpuszczona α-D-glukopiranoza, to roztwór tuż po rozpuszczeniu wykazuje skręcalność właściwą [α]D = +112,2°, lecz w miarę upływu czasu skręcalność ta stopniowo spada do wartości charakterystycznej w stanie równowagi, mianowicie [α]D = +52,7° |
Jak należy ogrzewać probówkę z roztworem w trakcie wykrywania kationów II grupy analitycznej, gdy powstaje H2S?
Jakie właściwości mierzą wiskozymetry?
W procedurze analitycznej zapisano. Ile wynosi zawartość procentowa Na2B4O7 • H2O w badanej próbce boraksu, jeżeli na zmiareczkowanie 0,3 g próbki zużyto 15,4 cm3 roztworu NaOH?
| 1 cm3 roztworu NaOH o stężeniu 0,1 mol/dm3 odpowiada 19,07 mg tetraboranu sodu Na2B4O7·H2O |
Jakie urządzenie wykorzystuje się do pomiaru zasolenia wody?
Proces, w wyniku którego formy wegetatywne mikroorganizmów ulegają zniszczeniu (pozostają jedynie bakterie w postaci spor oraz tzw. wolne wirusy), nazywany jest
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W wyniku badań mikrobiologicznych wody przeznaczonej do produkcji soków, po 3 dniach inkubacji stwierdzono w 1 ml próbki 100 j.t.k. bakterii, w tym 2 j.t.k Escherichia coli.
Ustal jakość wody na podstawie informacji zamieszczonych w tabeli.
| Wymagania mikrobiologiczne, jakim powinna odpowiadać woda | ||
|---|---|---|
| Lp. | Parametr | Najwyższa dopuszczalna wartość liczby jednostek tworzących kolonię [j.t.k] |
| 1 | Escherichia coli | 0 |
| 2 | Enterokoki | 0 |
| 3 | Pseudomonas aeruginosa | 0 |
| 4 | Ogólna liczba mikroorganizmów w (36±2) °C po 48h | 20 |
| 5 | Ogólna liczba mikroorganizmów w (22±2) °C po 72h | 100 |
Wielkość określająca zmienność wyników przy wielokrotnym pomiarze tego samego składnika tą samą metodą nosi nazwę
Na rysunku przedstawiono schemat aparatury do oznaczania w wodzie
Jakie urządzenie wykorzystuje się do hodowli bakterii w warunkach beztlenowych?
Gęstość wody w temperaturze 25oC wynosi
| T [K] | ||
|---|---|---|
| T [K] | d [g/cm³] | η [cP] |
| 293 | 0,99823 | 1,0050 |
| 298 | 0,99707 | 0,8937 |
| 303 | 0,99567 | 0,8007 |
| 308 | 0,99406 | 0,7225 |
| 313 | 0,99222 | 0,6560 |
| 318 | 0,99025 | 0,5988 |
| 323 | 0,98807 | 0,5494 |
| 328 | 0,98573 | 0,5064 |
| 333 | 0,98324 | 0,4688 |
Widoczne bez użycia mikroskopu skupisko mikroorganizmów, które powstało z jednej komórki na płytce z podłożem hodowlanym, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Analiza wody basenowej w celu wykrycia bakterii polega na podgrzewaniu próbki w inkubatorze przez 48 godzin w temperaturze 36±2°C. Jaki proces jest opisany?
Aby przygotować podłoże do badań mikrobiologicznych, należy
Reakcja jonu Ag+ z substancją pełniącą rolę odczynnika grupowego, 4g+ + Cl- —> AgCl ↓, jest typowa dla kationów z grupy
W ramce scharakteryzowano odczynniki
| Łączą się z danym jonem ubocznym, wiążąc go w trwałe zespoły i tym samym wyłączają go z udziału w roztworze lub obniżają znacznie jego stężenie. |
Jaką metodę analityczną stosuje się do pomiaru przewodnictwa cieczy umieszczonej między dwiema elektrodami, do których dostarczany jest prąd zmienny?
Metoda analityczna, która polega na wyznaczaniu masy osadzonej substancji z roztworu z wykorzystaniem azotanu(V) srebra, to
W tabeli przedstawiono kolejne etapy barwienia preparatu mikroskopowego metodą
| Etap 1 | Nałożenie barwnika – fioletu krystalicznego. |
| Etap 2 | Nałożenie płynu Lugola. |
| Etap 3 | Naniesienie alkoholu. |
| Etap 4 | Naniesienie barwnika – fuksyny zasadowej. |
Na podstawie rysunku analitem może być roztwór
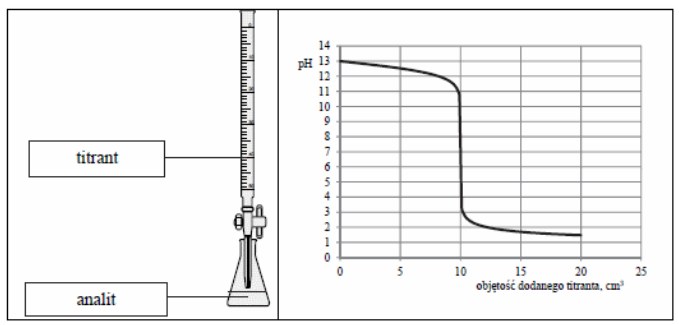
Podstawą klasyfikacji kationów w analizie jakościowej jest wydzielanie trudno rozpuszczalnych osadów?
Roztwór, w którym uzyskano stan równowagi dynamicznej, powinien być określany jako
Oblicz ilość amoniaku w badanej próbce, jeśli do jej zmiareczkowania wykorzystano 20,0 cm3 roztworu HCl o stężeniu 0,1 mol/dm3.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.