Pytanie 1
Aby określić całkowitą zawartość żelaza w próbce wody, konieczne jest zredukowanie żelaza(III) do żelaza(II), a następnie wykorzystanie metody analitycznej, która nazywa się
Wynik: 24/40 punktów (60,0%)
Wymagane minimum: 20 punktów (50%)
Aby określić całkowitą zawartość żelaza w próbce wody, konieczne jest zredukowanie żelaza(III) do żelaza(II), a następnie wykorzystanie metody analitycznej, która nazywa się
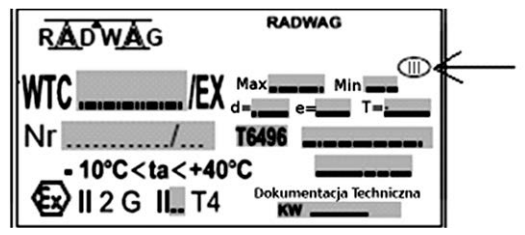
Strzałka zamieszczona na rysunku, przedstawiającym tabliczkę znamionową wagi, wskazuje na
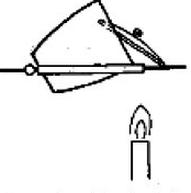
W procesie oddzielania osadu od cieczy podczas realizacji analiz jakościowych metodą półmikro, używa się
Reakcja, na której opiera się oznaczenie liczby zmydlania (LZ) tłuszczów, to
Ustalenie wartości miana roztworu wodorotlenku sodu na wodoroftalan potasu jest rekomendowane przez IUPAC, ponieważ wodoroftalan potasu jest substancją
Zjawisko polegające na chemicznej modyfikacji substancji, które prowadzi do powstania innego związku, łatwiejszego do oznaczenia przy użyciu konkretnej metody, to
Który proces przedstawiono na zamieszczonym rysunku?
Rozpuszczono próbkę technicznego chlorku sodu w wodzie, a jony chlorkowe strącono przy pomocy AgNO3, w postaci AgCl, którego masa po wysuszeniu wyniosła 1,5000 g. Oblicz ilość chloru w analizowanej próbce. Mnożnik analityczny dla chloru w AgCl to 0,2474.
Zamieszczony w ramce opis określa liczbę
| Liczba gramów fluorowca, przeliczona na gramy jodu, który w określonych warunkach ulega reakcji addycji do atomów węgla związanych wiązaniem wielokrotnym, zawartych w 100 g badanego tłuszczu. Jest ona proporcjonalna do liczby wiązań wielokrotnych w tłuszczach. |
Próbkę tłuszczu poddano analizie, której wyniki zapisano w tabeli. Która substancja była zawarta w próbce?
| Odczynnik | Obserwacje |
|---|---|
| woda bromowa | odbarwienie wody bromowej |
W której z reakcji opisanych równaniami mangan ulega utlenieniu?
Przedstawione równania reakcji zachodzą podczas oznaczania chlorków metodą
| Ag+ + Cl- → AgCl 2Ag+ + CrO42- → Ag2CrO4 |
Określenie stężenia jonów Fe3+ w wodzie pitnej powinno być zrealizowane przy użyciu metody
Zjawisko dzielenia się składników mieszaniny pomiędzy fazę stacjonarną a ruchomą w układzie to proces widoczny w
Wzorzec glukozy o stężeniu 0,5 mg/cm3 wykazuje absorbancję 0,150. Jakie jest stężenie glukozy w badanej próbie, jeśli jej absorbancja wynosi 0,450 przy założeniu spełnienia prawa Lamberta-Beera w badanym zakresie stężeń i identycznych warunkach pomiaru?
stężenie glukozy [mg/cm3] = Ap / Aw · cw Ap - absorbancja próbki Aw - absorbancja wzorca cw - stężenie wzorca [mg/cm3] |
W procedurze wykrywania cukrów stosowane są następujące. Wymienione związki chemiczne służą do sporządzenia odczynników
| CuSO4·5H2O, NaOH, C2H4O2(COO)2NaK, H2SO4. |
W trakcie mikrobiologicznych analiz żywności przed posiewem konieczne jest dokonanie rozcieńczenia próbki. W tym celu po dokładnym wymieszaniu badanego płynu pobiera się 10 cm3 za pomocą jałowej pipety, umieszcza w kolbie z 90 cm3 płynu rozcieńczającego i starannie miesza. Następnie z pierwszego rozcieńczenia przenosi się 1 cm3 do probówki, wzbogaconej o 9 cm3 płynu rozcieńczającego. W ten sposób uzyskuje się rozcieńczenie
Badanie obecności pałeczek Salmonella w produktach spożywczych klasyfikuje się jako analiza
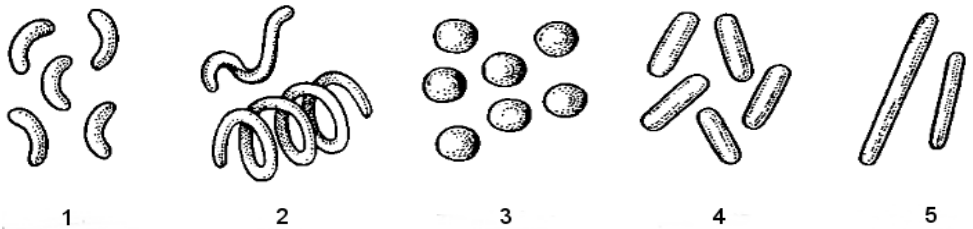
Wskaż właściwe uporządkowanie kształtów bakterii przedstawionych na rysunku.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Oznaczono LZ i LJ dla czterech różnych próbek tłuszczów. Wyniki zestawiono w tabeli:
Na podstawie zamieszczonych danych o liczbach właściwych wybranych tłuszczów wskaż próbkę, którą stanowi olej rzepakowy.
| Liczby właściwe wybranych tłuszczów | ||
|---|---|---|
| Rodzaj tłuszczu | Liczba zmydlania (LZ) mg KOH / g tłuszczu | Liczba jodowa (LJ) g I₂ / 100 g tłuszczu |
| Olej lniany | 187 – 197 | 169 – 192 |
| Olej sojowy | 188 – 195 | 114 – 138 |
| Olej rzepakowy | 167 – 179 | 94 – 106 |
| Tran wielorybi | 170 – 202 | 102 – 144 |
| Masło krowie | 218 – 245 | 25 – 38 |
| Smalec wieprzowy | 193 – 200 | 46 – 66 |
| Próbka | Liczba zmydlania (LZ) | Liczba jodowa (LJ) |
|---|---|---|
| 1 | 190 | 140 |
| 2 | 171 | 99 |
| 3 | 194 | 105 |
| 4 | 195 | 60 |
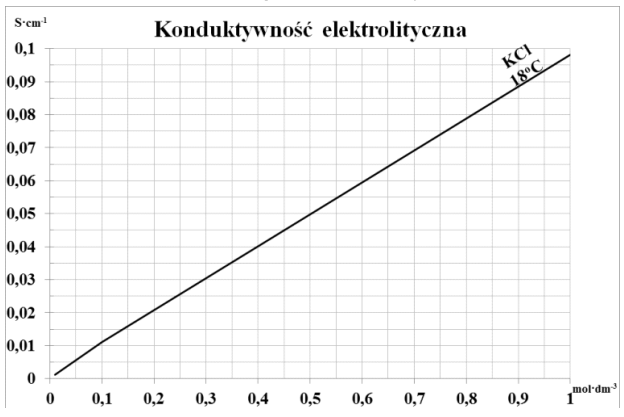
W celu wyznaczenia stężenia badanej próbki chlorku potasu, wykonano krzywą wzorcową zależności konduktywności elektrolitycznej od stężenia. Przewodność badanego roztworu wyniosła 0,045 S∙cm-1. Stężenie badanego roztworu KCl wynosi
Widoczne bez użycia mikroskopu skupisko mikroorganizmów, które powstało z jednej komórki na płytce z podłożem hodowlanym, to
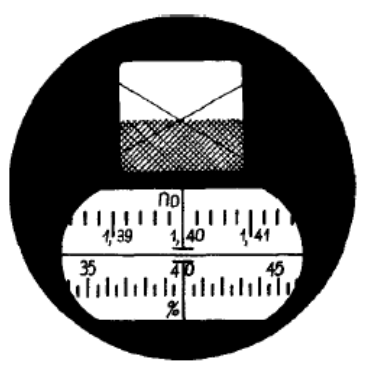
Na rysunku przedstawione jest pole widzenia
Zawartość olejku w liściach eukaliptusa zmierzono za pomocą destylacji w aparacie Derynga. Z 20 g surowca uzyskano 0,5 cm3 olejku o gęstości 0,920 g/cm3. Jak oblicza się procentową zawartość olejku w liściach eukaliptusa?
Jakie jest zastosowanie metody Winklera?
Jaką substancję podstawową powinno się użyć do ustalania miana roztworu wodorotlenku sodu?
W metodzie analitycznej zapisano. Który parametr metody analitycznej opisano w ramce?
| Różnica w otrzymanych wynikach dwóch oznaczeń wykonanych równocześnie lub w krótkim przedziale czasu na tej samej próbce, przez tego samego analityka, w takich samych warunkach, nie może przekraczać 1,5 g na 100 g oznaczanej próbki. |
Określ typ destylacji, który polega na przemianie składnika mieszaniny substancji organicznych w stan pary w temperaturze niższej od jego temperatury wrzenia.
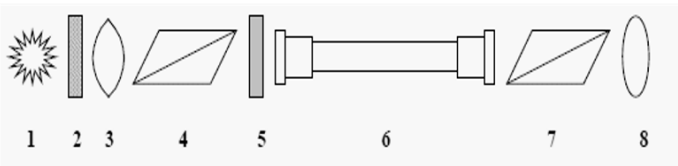
Na rysunku przedstawiającym schemat polarymetru, cyfrą 4 oznaczono
W ramce przedstawiono równania reakcji zachodzące podczas oznaczania chlorków metodą
| Ag+ + Cl- → AgCl ↓ |
| Ag+ + SCN- → AgSCN ↓ |
| Fe3+ + SCN- → Fe(SCN)2+ |
W celu identyfikacji cukru przeprowadzono doświadczenia, których wyniki zapisano w tabeli. Identyfikowanym cukrem była
| Doświadczenie | Wynik doświadczenia |
|---|---|
| Próba Trommera | ceglastoczerwony osad |
| Próba Tollensa | lustro srebrne |
| Próba z wodą bromową w obecności wodorowęglanu sodu | odbarwienie wody bromowej |
Podczas miareczkowania roztworu amoniaku o stężeniu 0,1 mol/dm3 za pomocą roztworu kwasu solnego o stężeniu 0,1 mol/dm3, skok krzywej leży w granicach pH 6,3–4,3. W tym miareczkowaniu jako wskaźnik należy zastosować
| Wskaźnik | Przedział pH |
| Błękit tymolowy | 1,2–2,8 |
| 8,0–9,6 | |
| Oranż metylowy | 3,1–4,4 |
| Czerwień metylowa | 4,2–6,2 |
| Błękit bromotymolowy | 6,7–7,6 |
| Fenoloftaleina | 8,0–9,8 |
| Tymoloftaleina | 9,3–10,5 |
Rysunek przedstawia
Który nawóz, spośród wymienionych w tabeli, zawiera najwięcej azotu azotanowego?
| Tabela. Zawartość składnika czynnego w nawozach azotowych | |
|---|---|
| Nawóz | Zawartość składników, % |
| Saletra potasowa | N – 13,5% |
| Saletra magnezowa | N – 10,8% |
| Saletra amonowa | N – 34% (NH4+ – 17%, NO3- – 17%) |
| Saletra wapniowa | N – 14,5% |
| Siarczan amonu | N – 21% |
| Mocznik | N – 46% |
Urządzeniem używanym do hodowli bakterii w środowisku beztlenowym jest
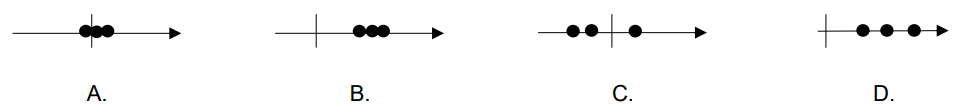
Na którym rysunku przedstawiono schemat metody dokładnej i nieprecyzyjnej?
Jaką objętość kwasu solnego o stężeniu 0,5 mol/dm3 należy wykorzystać do całkowitego zobojętnienia 100 cm3 roztworu wodorotlenku sodu o stężeniu 0,4 mol/dm3?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie substancje stosuje się do barwienia preparatów mikroskopowych według metody Grama?