Pytanie 1
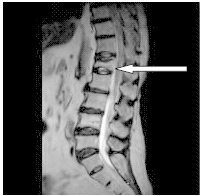
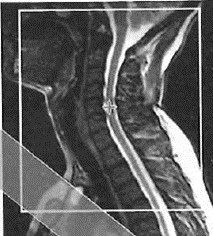
Na obrazie rezonansu magnetycznego strzałką oznaczono patologiczny kręg
Wynik: 12/40 punktów (30,0%)
Wymagane minimum: 20 punktów (50%)
Na obrazie rezonansu magnetycznego strzałką oznaczono patologiczny kręg

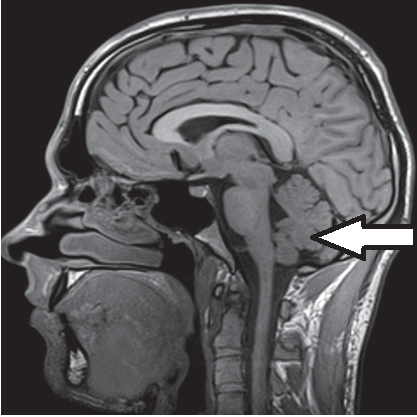
Którą strukturę anatomiczną oznaczono strzałką na obrazie rezonansu magnetycznego?
W której technice brachyterapii stosuje się źródła promieniowania o mocy dawki 2-12 Gy/h?
W zapisie EKG załamki P dodatnie w odprowadzeniu I i II, a ujemne w aVR oraz częstotliwość rytmu mniejsza niż 60/min wskazują na
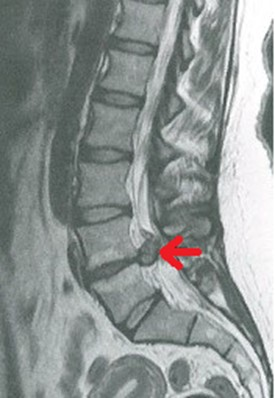
Na obrazie MR kręgosłupa lędźwiowego strzałką wskazano
Na jakim etapie procesu karcynogenezy dochodzi do inwazji miejscowej nowotworu i tworzenia przerzutów odległych?
Przemiana promieniotwórcza radu w ren opisana wzorem \( {}_{88}^{226}\text{Ra} \to {}_{86}^{222}\text{Rn} + {}_{2}^{4}\text{He} \) jest rozpadem
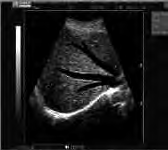
Na obrazie ultrasonograficznym jamy brzusznej uwidoczniono
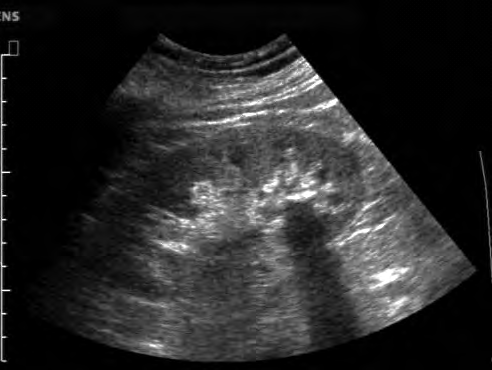
Na obrazie ultrasonograficznym jamy brzusznej uwidoczniono
Brachyterapia wewnątrzprzewodowa jest stosowana w leczeniu
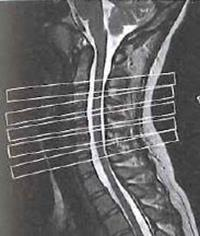
Na którym obrazie MR jest widoczne pasmo saturacji?

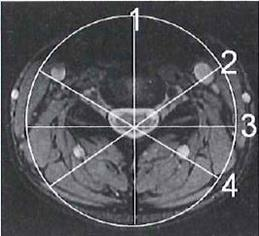
Pracownia radioterapii z przyspieszaczem liniowym jest obszarem
W trakcie obrazowania metodą rezonansu magnetycznego wykorzystywane jest zjawisko wysyłania sygnału emitowanego przez
Testy specjalistyczne aparatów rentgenowskich do zdjęć wewnątrzustnych są przeprowadzane
Które środki kontrastujące wykorzystywane są w diagnostyce rezonansem magnetycznym?
Podczas badania EEG otwarcie oczu powoduje
Do zadań technika elektroradiologa w pracowni hemodynamicznej należy
Jak konwencjonalnie frakcjonuje się dawkę w teleradioterapii?
Podczas wykonywania zdjęcia rentgenowskiego lewobocznego czaszki promień centralny powinien przebiegać
Rozpraszanie promieniowania X, w wyniku którego następuje zwiększenie długości fali promieniowania, to zjawisko
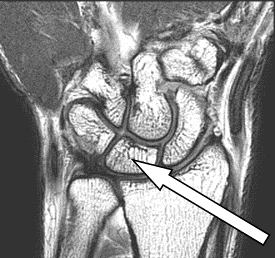
Na zamieszczonym obrazie RM nadgarstka lewego strzałką wskazano kość
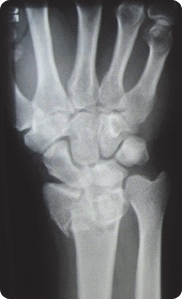
Na radiogramie uwidoczniono złamanie nasady
Przy ułożeniu do zdjęcia kręgów szyjnych CIII-CVII w projekcji przednio-tylnej lampa może być odchylona o kąt
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
Nieostrość geometryczna obrazu rentgenowskiego zależy od
W której próbie stroikowej przystawia się stroik do czoła (u podstawy nosa) lub na szczycie głowy i porównuje się przewodnictwo kostne ucha prawego i lewego?
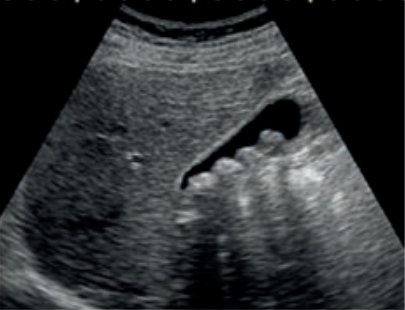
Jakie struktury anatomiczne uwidoczniono na obrazie USG?
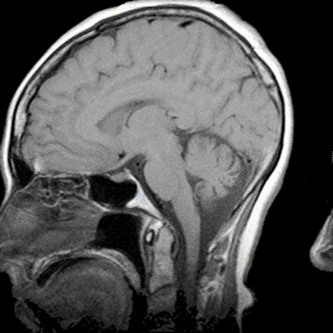
Który artefakt uwidoczniono na skanie RM głowy?
Po podaniu kontrastu obraz zmian nowotworowych w badaniu MR najlepiej uwidacznia się w sekwencji
W brachyterapii MDR stosowane są dawki promieniowania
Przy ułożeniu do zdjęcia kręgów szyjnych CIII-CVII w projekcji przednio-tylnej lampa może być odchylona o kąt
Jaki sposób frakcjonowania dawki jest stosowany w radioterapii konwencjonalnej?
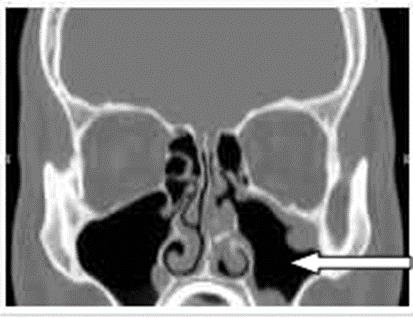
Na zamieszczonym obrazie TK strzałką zaznaczono zatokę
W badaniu cystografii wstępującej środek kontrastowy należy podać
Który obszar napromieniania w radioterapii oznacza się skrótem PTV?
Przy podejrzeniu ciała obcego w oczodole należy wykonać
Odprowadzenie II rejestruje różnicę potencjałów między
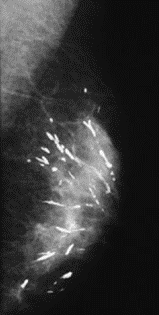
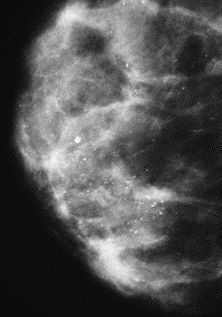
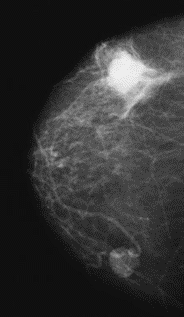
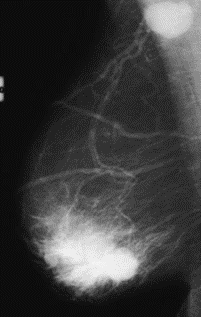
Na którym obrazie rentgenowskim sutka uwidoczniono zmianę patologiczną w obrębie węzłów chłonnych?
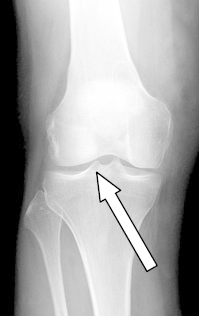
Którą strukturę anatomiczną oznaczono strzałką na radiogramie stawu kolanowego?
Przyczyną zaniku kostnego jest