Pytanie 1
Rozpuszczalniki organiczne powinny być składowane
Wynik: 13/40 punktów (32,5%)
Wymagane minimum: 20 punktów (50%)
Rozpuszczalniki organiczne powinny być składowane
Aby uzyskać roztwór 25 gramów CuSO4 w 50 gramach wody, konieczne jest podgrzanie mieszanki do temperatury w przybliżeniu
Kalibracja pH-metru nie jest potrzebna po
Jakie procesy towarzyszy efekt egzotermiczny?
W celu sprawdzenia stężenia kwasu siarkowego(VI) odważono 1 g badanego kwasu i przeprowadzono analizę miareczkową, w której zużyto 20,4 \( \text{cm}^3 \) roztworu NaOH.
Stężenie procentowe badanego kwasu, obliczone na podstawie wzoru wynosi
$$ C_p = \frac{0,02452 \cdot V_{NaOH}}{mp} \cdot 100\% $$gdzie:
\( C_p \) – stężenie procentowe badanego kwasu; \( \% \)
\( 0,02452 \) – współczynnik przeliczeniowy; \( \text{g/cm}^3 \)
\( V_{NaOH} \) – objętość roztworu NaOH, zużyta w miareczkowaniu; \( \text{cm}^3 \)
\( mp \) – odważka badanego kwasu; g
Na etykiecie próbki środowiskowej należy umieścić datę jej pobrania, lokalizację poboru oraz
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
Jakim przyrządem nie jest możliwe określenie gęstości cieczy?
Jak przebiega procedura unieszkodliwiania rozlanego kwasu siarkowego(VI)?
Mianowanie roztworu o stężeniu przybliżonym można wykonać poprzez
Oblicz stężenie molowe 250 cm3 roztworu NaOH, w którym znajduje się 0,5 g substancji. Masa molowa NaOH wynosi 40 g/mol
Zawarty fragment instrukcji odnosi się do
Po dodaniu do kolby Kjeldahla próbki analizowanego materiału, kwasu siarkowego(VI) oraz katalizatora, należy delikatnie ogrzewać zawartość kolby za pomocą palnika gazowego. W początkowym etapie ogrzewania zawartość kolby wykazuje pienienie i zmienia kolor na ciemniejszy. W tym czasie należy przeprowadzać ogrzewanie bardzo ostrożnie, a nawet z przerwami, aby uniknąć "wydostania się" czarnobrunatnej masy do szyjki kolby.
W jakiej standardowej temperaturze są kalibrowane szklane naczynia pomiarowe?
Na podstawie informacji zawartych w tabeli określ, który parametr spośród podanych należy oznaczyć w pierwszej kolejności.
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godziny |
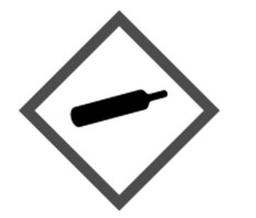
Zamieszczony piktogram odnosi się do substancji o klasie i kategorii zagrożenia:
Podczas przygotowywania roztworów buforowych do analizy pH w laboratorium istotne jest, aby:
Skrót "cz." na etykiecie odczynnika chemicznego wskazuje, że
Podczas pomiaru masy substancji w naczyniu wagowym na wadze technicznej, dla zrównoważenia ciężaru na szalce umieszczono odważniki: 20 g, 2 g, 500 mg, 200 mg, 20 mg, 10 mg, 10 mg oraz 5 g. Całkowita masa substancji z naczynkiem wyniosła
Na etykiecie odważki analitycznej znajduje się napis: Z odważki tej można przygotować
Odważka analityczna azotan(V) srebra(I) AgNO3 0,1 mol/dm3 |
Ze względu na czystość, substancja oznakowana zamieszczoną etykietą powinna być wykorzystywana głównie do

Podczas krystalizacji 210 g technicznego bezwodnego siarczanu(VI) cynku uzyskano 250 g ZnSO4 x 7H2O. Jaka była wydajność procesu krystalizacji?
Aby podnieść stężenie mikroelementów w roztworze, próbkę należy poddać
Oddzielanie płynnej mieszaniny wieloskładnikowej poprzez odparowanie, a następnie skraplanie jej komponentów, to proces
Wskaź sprzęt laboratoryjny, który znajduje się w zestawie do filtracji pod obniżonym ciśnieniem?
Oddzielanie płynnej mieszanki poprzez jej odparowanie, a potem skroplenie poszczególnych składników to
Proces oddzielania mieszaniny niejednorodnej, który zachodzi w wyniku opadania cząstek pod działaniem grawitacji, nazywamy
Na etykiecie kwasu siarkowego(VI) znajduje się zapis:
Określ gęstość kwasu siarkowego(VI).
KWAS SIARKOWY MIN. 95% CZ.D.A. H2SO4 M = 98,08 g/mol 1 l – 1,84 kg |
Na ilustracji przedstawiono sprzęt stosowany do sączenia osadu
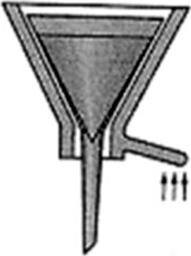
W trakcie destylacji cieczy wykorzystuje się tzw. kamienie wrzenne, ponieważ
Jakie jest stężenie molowe roztworu, jeśli w 100 cm3 roztworu znajduje się 5,6 g KOH?
MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol
Po zakończeniu pomiarów pH, elektrody powinny być przepłukane
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Butle gazowe (czasy butli) napełnione wodorem są oznaczone kolorem
Aby uzyskać wodorotlenek wapnia, odważono 30 g węglanu wapnia, który następnie wyprażono. Powstały tlenek wapnia dodano do 100 cm3 wody, a otrzymany osad wysuszono i zważono, uzyskując 18,5 g wodorotlenku wapnia. Jaką wydajność miała ta reakcja?
Ca – 40 g/mol; O – 16 g/mol; C – 12 g/mol; H – 1 g/mol
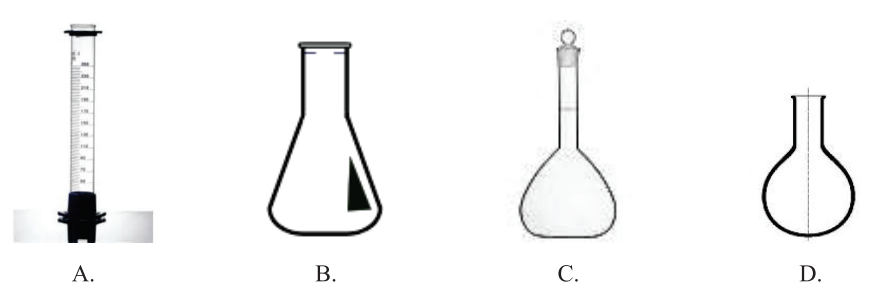
W celu przygotowania roztworu mianowanego należy użyć sprzętu przedstawionego na rysunku
Metoda przygotowania próbki do badania, która nie jest
Aby przeprowadzać ręczną obróbkę szkła w laboratorium, konieczne jest posiadanie okularów ochronnych oraz rękawic.
Nie należy używać gorącej wody do mycia
Określ, jakie informacje powinny być zarejestrowane w ewidencji wydania substancji niebezpiecznych, stosowanych w badaniach laboratoryjnych?
Aby przygotować 250 cm3 0,2-molowego roztworu wodorotlenku sodu, należy odważyć
| MNaOH = 40g / mol |