Pytanie 1
Jaką substancję podstawową powinno się użyć do ustalania miana roztworu wodorotlenku sodu?
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Jaką substancję podstawową powinno się użyć do ustalania miana roztworu wodorotlenku sodu?
Elektroforeza to technika wykorzystywana głównie do segregacji mieszaniny
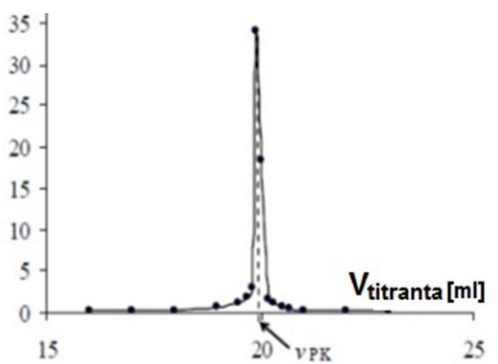
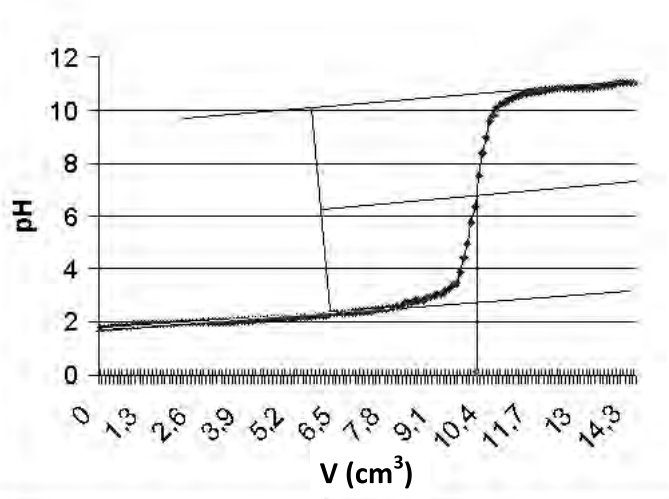
Sporządzono wykres potencjometrycznego miareczkowania alkacymetrycznego. W jaki sposób należy opisać oś Y?
| A. | ΔpH/ΔVtitranta |
| B. | ΔSEM/ΔVtitranta |
| C. | pH/ΔVtitranta |
| D. | SEM/ΔVtitranta |
Podczas reakcji ksantoproteinowej obecność białka jest potwierdzana przez zmianę koloru na żółty, co wskazuje na obecność w białku
Zespół enzymów, obecny zarówno w organizmach roślinnych, jak i zwierzęcych, który katalizuje proces hydrolizy wiązań peptydowych w białkach oraz peptydach, to
Przedstawiony wzór opisuje titrant stosowany podczas miareczkowania
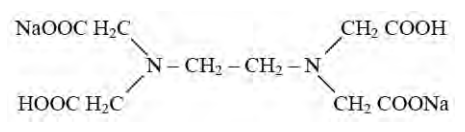
Działanie, które ma na celu określenie relacji pomiędzy wartościami mierzonymi dla wzorcowych próbek a odczytami systemu pomiarowego, realizowane w specyficznych warunkach, to
Do zmiany objętości próbki roztworu NaOH wykorzystano 10,0 cm3 roztworu HCl o stężeniu 0,1000 mol/dm3. Jaką ilość NaOH (M = 40 g/mol) zawierała próbka?
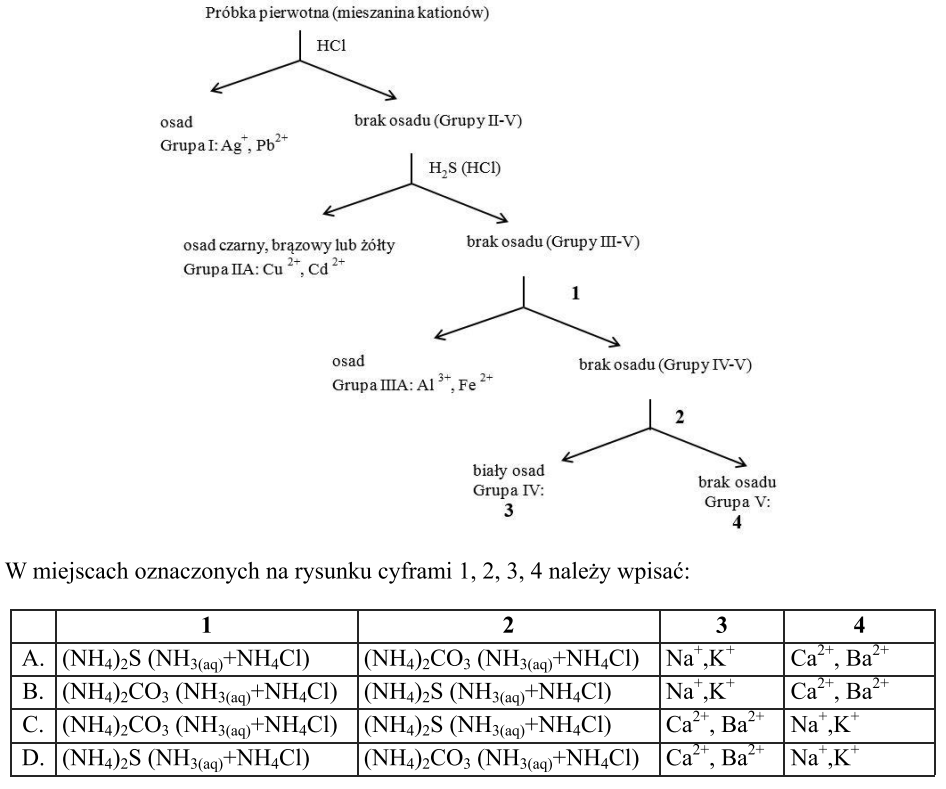
Wykonano identyfikację opisaną w schemacie:
BaCl2 + X — biały osadJaki wzór reprezentuje substrat X?
Jakie jest zastosowanie psychrometru aspiracyjnego?
Elektroforeza to zjawisko elektrokinetyczne, które wykorzystuje się w analizie
Jakie jest stężenie analitu wyrażone w procentach, gdy próbka analityczna zawiera 250 ppm analitu?
Schemat obrazuje proces rozdzielenia mieszaniny kationów.
Próbka pierwotna (mieszanina kationów)
W tabeli przedstawiono skalę wzorców do oznaczania barwy wody.
Wyznacz barwę badanej próbki wody, korzystając ze wzoru:
| Numer wzorca | 1. | 2. | 3. | 4. | 5. |
| Odmierzona ilość roztworu wzorcowego [cm3] | 0 | 1 | 2 | 3 | 4 |
| Barwa w stopniach mg Pt/dm3 | 0 | 5 | 10 | 15 | 20 |
| Objętość badanej próbki wody [cm3] | 100 |
| Wzorzec | 2. |
gdzie:
a – odczytana ze skali wzorców barwa próbki, mg Pt/dm³
V – objętość próbki, cm³
Po przeprowadzeniu procesu elektrolizy wodnego roztworu określonego związku, na katodzie pojawił się wodór, a na anodzie tlen. Który z tych związków został poddany elektrolizie?
W celu identyfikacji czterech próbek cukrów zbadano ich skręcalność właściwą. Błąd systematyczny pomiaru wynosił + 10%. Wynik próbki pierwszej to + 57,8°. Na podstawie danych zawartych w tabeli można stwierdzić, że badanym cukrem jest
| Skręcalność właściwa roztworów niektórych związków optycznie czynnych (w temp. 20°C) | ||
|---|---|---|
| Substancja | Rozpuszczalnik | Skręcalność właściwa |
| Sacharoza | Woda | + 66,5° |
| Glukoza | Woda | + 52,5° |
| Fruktoza | Woda | + 93,0° |
| Maltoza | Woda | + 136,9° |
Który zbiór zawiera jedynie odczynniki grupowe używane w analizie jakościowej jonów?
Oceniając organoleptycznie wodę przeznaczoną do picia przez ludzi, należy określić między innymi
Komplekson III (sól disodowa kwasu etylenodiaminotetraoctowego) używana w analizie objętościowej tworzy z metalami kompleksy w stosunku ligandu do metalu
Na podstawie informacji zamieszczonych w tabeli wskaż wzór związku, który wytrąci się w postaci osadu.
| Badany kation | Odczynnik grupowy | NaOH | Barwienie płomienia |
|---|---|---|---|
| Mg2+ | brak | biały osad | |
| K+ | brak | fiołkowy | |
| Na+ | brak | żółty |
W tabeli przedstawiono charakterystykę
| |||||||||||||||
Jakie jest zastosowanie metody Winklera?
Sprzyja tworzeniu osadów grubokrystalicznych w czystszej formie oraz umożliwiających łatwiejsze sączenie
Które z przedstawionych reakcji zachodzą na elektrodach platynowych podczas elektrolizy azotanu(V) miedzi(II)?
| A. | K(–) Cu2+ + 2e → Cu | A(+) 2H+ + 2e → H2 |
| B. | K(–) 2H2O → O2 + 4H+ + 4e | A(+) Cu2+ + 2e → Cu |
| C. | K(–) Cu2+ + 2e → Cu | A(+) 2H2O → O2 + 4H+ + 4e |
| D. | K(–) Cu2+ + 2e → Cu | A(+) 4OH– → O2 + 2H2O + 4e |
Woda obecna w cząsteczce Ca(OH)2 określana jest jako woda
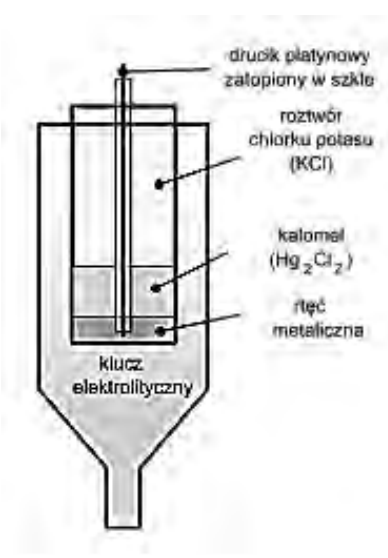
Na rysunku przedstawiono schemat elektrody
Metalowe wskaźniki są wykorzystywane w analizach
W wyniku pomiaru wagowego uzyskano 0,2451 g tlenku żelaza(III). Jaką masę żelaza zawierała badana próbka? MFₑ = 55,845 g/mol, MO = 15,999 g/mol?
W treści metody analitycznej napisano:
Różnica w wynikach dwóch pomiarów przeprowadzonych jednocześnie lub w krótkim odstępie czasowym na tej samej próbce, przez tego samego analityka, w identycznych warunkach, nie powinna być większa niż 1,5 g na 100 g analizowanej próbki.
Jaki parametr metody analitycznej został opisany?
Na rysunku przedstawione jest pole widzenia
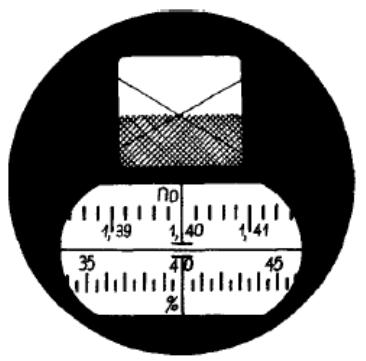
Przedstawioną na rysunku krzywą wyznaczono przy pomocy
Która z wymienionych soli w roztworze wodnym ma charakter kwasowy?
Do technik rozdzielania należy
Analiza, która opiera się na kontrolowanym wprowadzaniu roztworu o znanym stężeniu do badanego roztworu, to metoda oznaczeń ilościowych zwana
Na podstawie danych zawartych w tabeli, wskaż zestaw substancji uporządkowanych według rosnącej temperatury topnienia.
| Substancja | pirydyna | benzen | etanol |
|---|---|---|---|
| Temperatura wrzenia [°C] | 115,5 | 80,1 | 78,3 |
| Temperatura topnienia [°C] | -41,6 | 5,5 | -114,1 |
Drobnoustroje posiadające zdolność do rozkładu białek oraz peptydów charakteryzują się właściwościami
Wartość liczby estrowej (LE), określona ilością miligramów KOH potrzebnych do zmydlenia estrów w 1 g analizowanego tłuszczu, wskazuje
Równania reakcji zamieszczone w ramce opisują oznaczanie w tłuszczach liczby
| −CH=CH− + IBr → −CHI−CHBr− IBr + KI → KBr + I2 I2+ 2Na2S2O3 →2NaI + Na2S4O6 |
W trakcie zmiareczkowania próbki roztworu NaOH zużyto 15,0 cm3 roztworu HCl o stężeniu 0,1 mol/dm3. Ilość NaOH (M = 40 g/mol) w analizowanej próbce wyniosła
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.