Pytanie 1
Która składowa prawidłowej krzywej EKG odpowiada powolnej repolaryzacji komór mięśnia sercowego?
Wynik: 38/40 punktów (95,0%)
Wymagane minimum: 20 punktów (50%)
Która składowa prawidłowej krzywej EKG odpowiada powolnej repolaryzacji komór mięśnia sercowego?
Na radiogramie uwidoczniono złamanie nasady
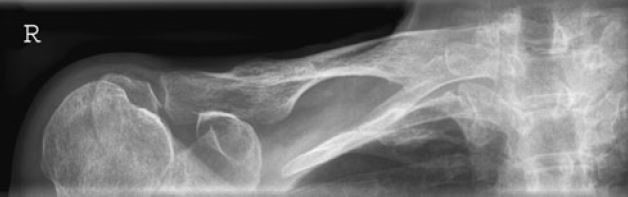
W jakiej projekcji i pod jakim kątem padania promienia centralnego został wykonany radiogram obojczyka?
Kasety do pośredniej radiografii cyfrowej CR są wyposażone
Na obrazie radiologicznym uwidoczniono złamanie kości
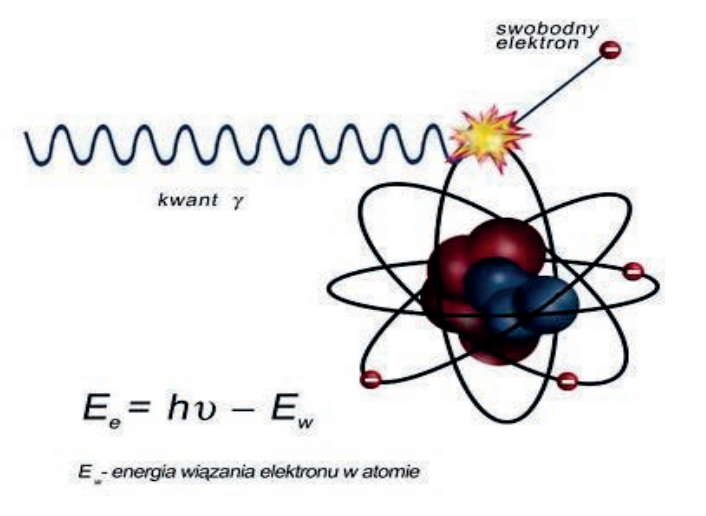
W medycynie nuklearnej wykorzystuje się:
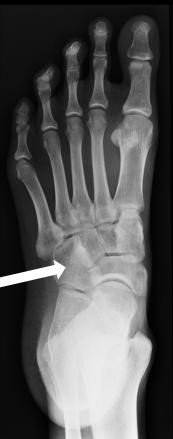
Którą kość zaznaczono strzałką na radiogramie stopy?
W audiometrii badanie polegające na maskowaniu (zagłuszaniu) tonów szumem białym to próba
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
W zapisie EKG linia izoelektryczna obrazuje
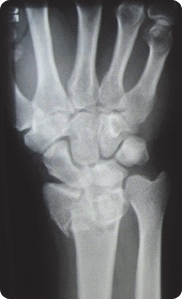
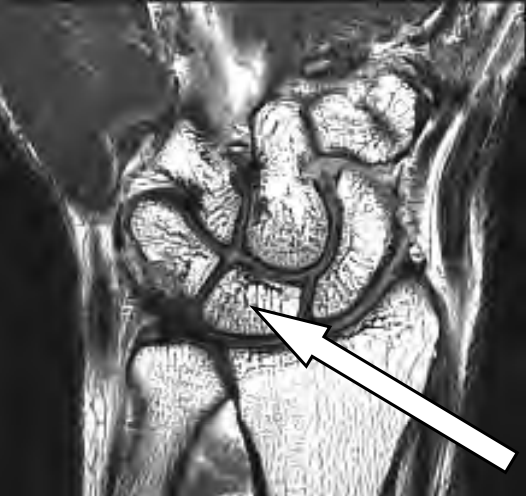
Na obrazie RM nadgarstka lewego strzałką oznaczono kość
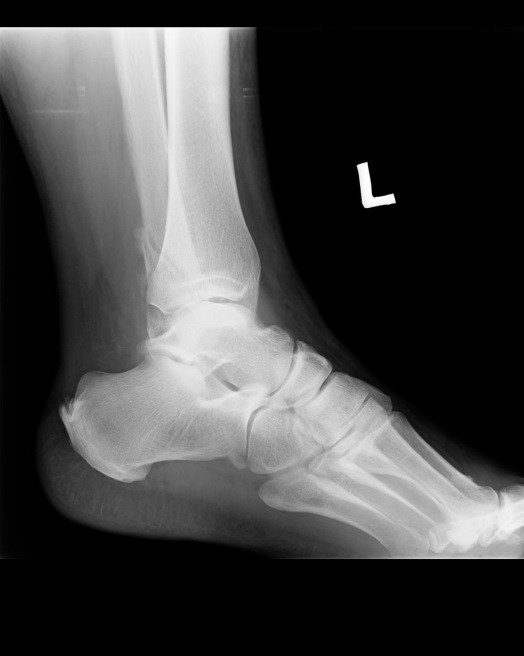
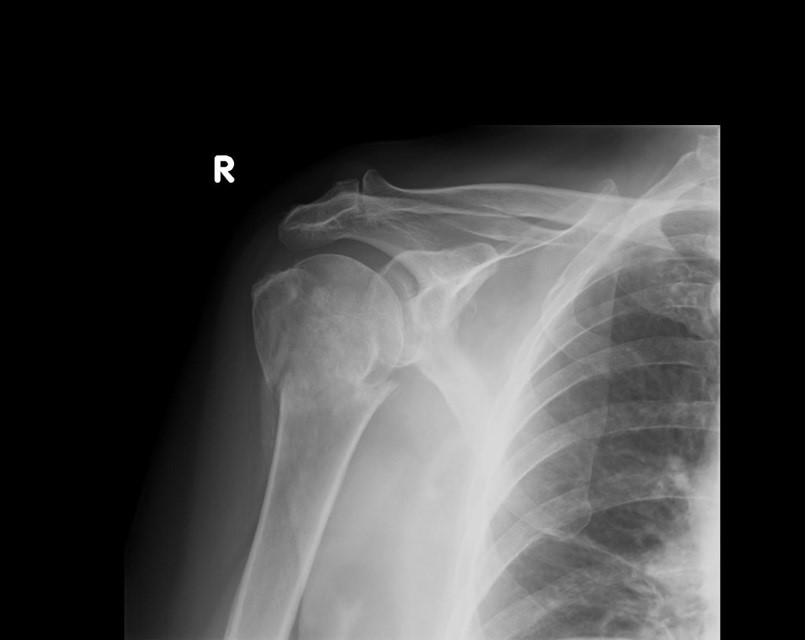
Na obrazie rentgenowskim strzałką zaznaczono
W obrazowaniu MR wykorzystuje się moment magnetyczny
Jak konwencjonalnie frakcjonuje się dawkę w teleradioterapii?
Podstawowym elementem diagnostycznym aparatury izotopowej wykorzystującej emisyjne metody pomiaru jest
Na radiogramie uwidoczniono złamanie
Lordoza to fizjologiczna krzywizna kręgosłupa występująca
W leczeniu izotopowym tarczycy podaje się
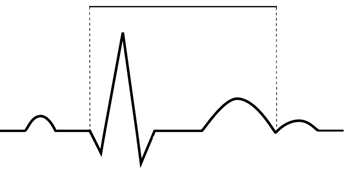
Na wykresie EKG zaznaczono
Jednostką indukcji magnetycznej jest
Osłony na gonady dla osób dorosłych powinny posiadać równoważnik osłabienia promieniowania nie mniejszy niż
Podczas badania gammakamerą źródłem promieniowania jest
Testy podstawowe z zakresu geometrii pola rentgenowskiego, przeznaczone do sprawdzenia zgodności pola wiązki promieniowania rentgenowskiego z symulacją świetlną, są wykonywane raz
W obrazowaniu metodą rezonansu magnetycznego T1 oznacza czas
Przy ułożeniu do zdjęcia kręgów szyjnych CIII-CVII w projekcji przednio-tylnej lampa może być odchylona o kąt
W zapisie EKG zespół QRS odzwierciedla
W badaniu EKG różnice potencjałów pomiędzy lewym podudziem a lewym przedramieniem rejestruje odprowadzenie
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
Na którym obrazie TK uwidoczniony jest artefakt spowodowany ruchami oddechowymi pacjenta?
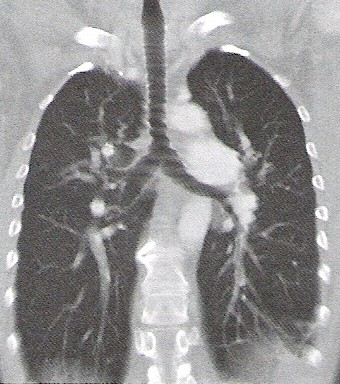
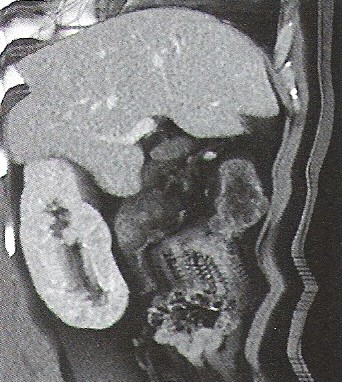
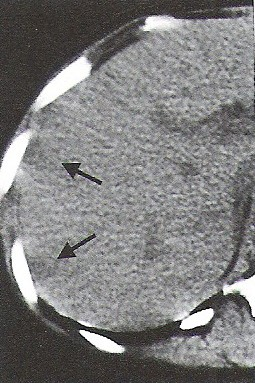

Na zamieszczonej rycinie przedstawiono
Podczas wykonywania zdjęć wewnątrzustnych zębów górnych linia Campera powinna przebiegać w stosunku do płaszczyzny podłogi
Wskaż osłonę radiologiczną, która jest stosowana w pracowniach radiodiagnostyki stomatologicznej.




Gruboziarnista folia wzmacniająca wpływa na zwiększenie na obrazie rentgenowskim nieostrości
Jaki rozmiar kasety należy zastosować, wykonując standardowe zdjęcie stawu kolanowego w projekcji bocznej?
Którą metodą zostało wykonane badanie kręgosłupa zobrazowane na zdjęciu?
Jakie wiązki promieniowania emituje medyczny akcelerator liniowy?
Która sekwencja obrazowania MR wykorzystuje impulsy RF o częstotliwości rezonansowej tłuszczu do tłumienia sygnału pochodzącego z tkanki tłuszczowej?
Zwiększenie napięcia na lampie rentgenowskiej powoduje
Do czego służy do symulator rentgenowski wykorzystywany w procesie radioterapii?
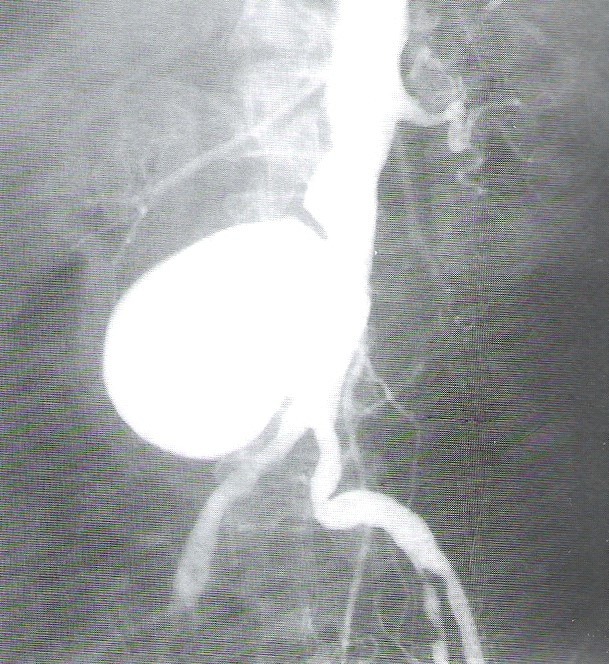
DSA to cyfrowa