Pytanie 1
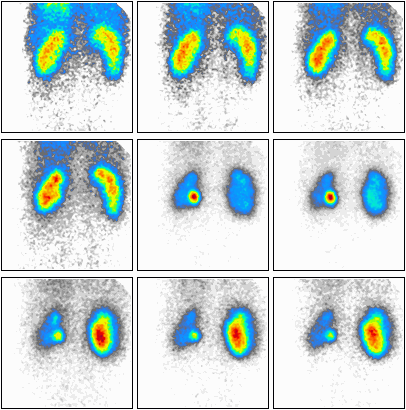
Podczas którego badania zostały zarejestrowane przedstawione obrazy?
Wynik: 36/40 punktów (90,0%)
Wymagane minimum: 20 punktów (50%)
Podczas którego badania zostały zarejestrowane przedstawione obrazy?

Proces chemicznego wywoływania radiogramów polega na
Zamieszczony elektrokardiogram przedstawia
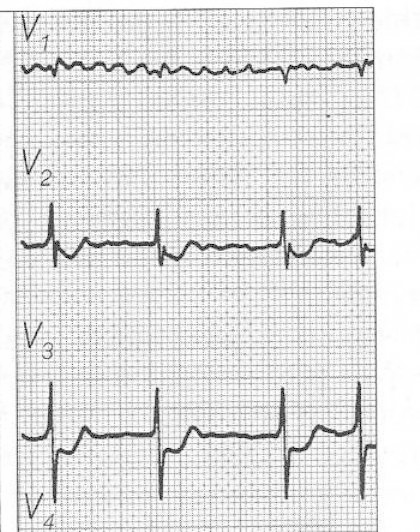
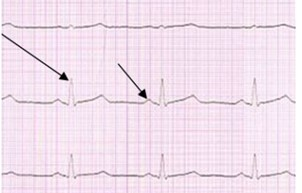
Który załamek w zapisie EKG odpowiada zjawisku depolaryzacji przedsionków mięśnia sercowego?
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Przy ułożeniu do zdjęcia kręgów szyjnych CIII-CVII w projekcji przednio-tylnej lampa może być odchylona o kąt
Skrótem HRCT (High Resolution Computed Tomography) określa się tomografię komputerową
Fistulografia to badanie kontrastowe
Do pomiaru dawek indywidualnych u osób narażonych zawodowo na promieniowanie rentgenowskie są stosowane
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
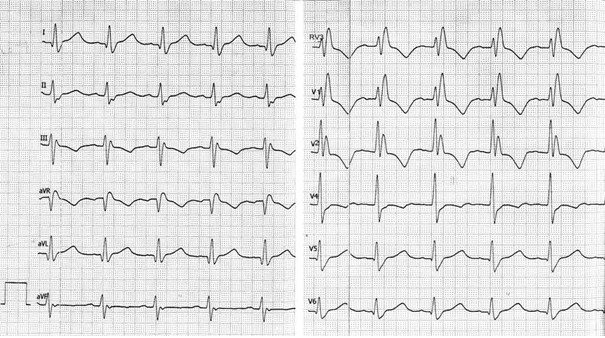
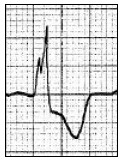
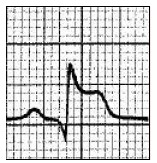
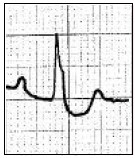
Przedstawiony zapis elektrokardiograficzny może wskazywać na
Jak zgodnie ze standardem należy ustawić pacjenta do badania rentgenowskiego w skosie tylnym prawym?
Na radiogramie uwidoczniono
W trakcie obrazowania metodą rezonansu magnetycznego wykorzystywane jest zjawisko wysyłania sygnału emitowanego przez
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
W badaniu EKG odprowadzenie I rejestruje różnicę potencjałów między
Na elektrokardiogramie strzałki wskazują załamki
W pozytonowej emisyjnej tomografii komputerowej PET radioznacznik podawany jest pacjentowi najczęściej
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
Które środki kontrastujące wykorzystywane są w diagnostyce rezonansem magnetycznym?
Glukoza podawana pacjentowi w badaniu PET jest znakowana radioaktywnym
Który zapis EKG przedstawia falę Pardee'go?

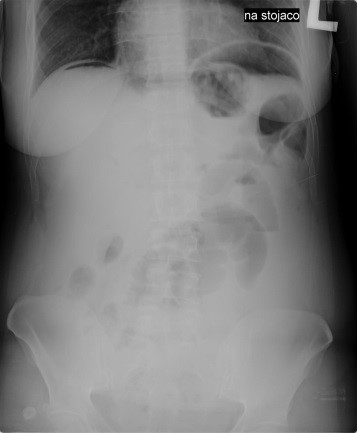
Radiogram jamy brzusznej uwidacznia
Kto jest odpowiedzialny za wykonywanie testów podstawowych kontroli jakości gammakamery w Zakładzie Medycyny Nuklearnej?
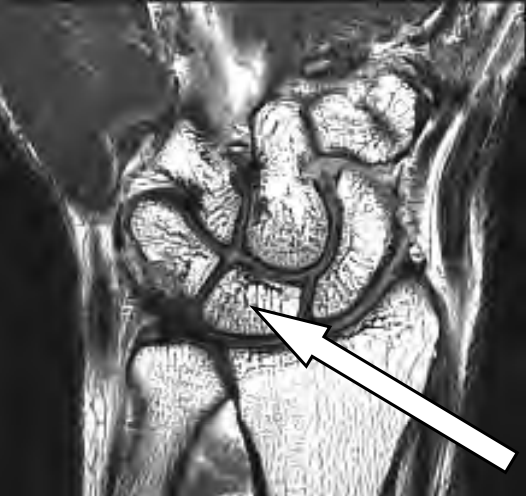
Na obrazie RM nadgarstka lewego strzałką oznaczono kość
Elementem pomocniczym w radioterapii, zapewniającym powtarzalność ułożenia w pozycji terapeutycznej, a także unieruchomienie pacjenta, jest
W których projekcjach podstawowych wykonuje się standardowe badanie mammograficzne?
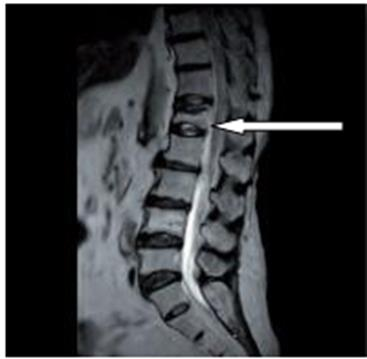
Na obrazie rezonansu magnetycznego strzałką wskazano patologiczny kręg
Podczas badania EEG w systemie „10-20” literą A oznacza się elektrody
Zastosowana w badaniu radiologicznym kratka przeciwrozproszeniowa powoduje
Limfografia to badanie kontrastowe
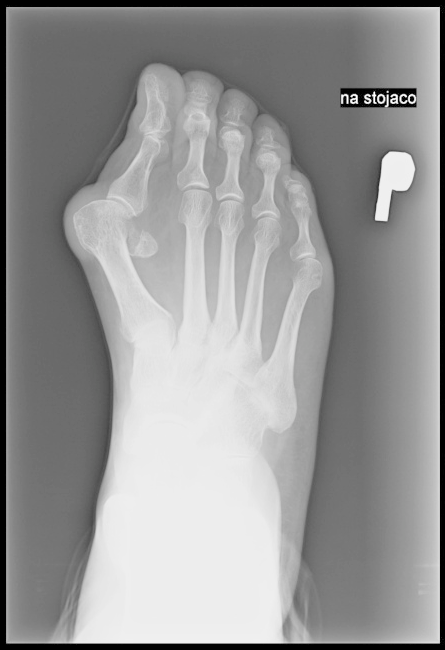
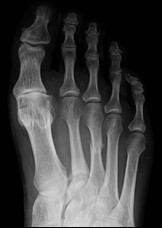
Na radiogramie stopy uwidocznione jest złamanie trzonu
W scyntygrafii kośćca „ogniska gorące” oznaczają miejsca
Jaka jest moc dawki pochłoniętej w brachyterapii HDR?
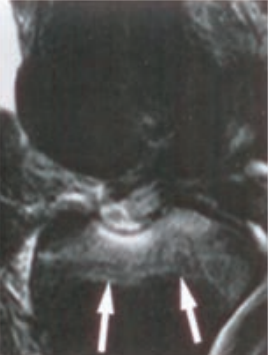
Obraz stawu kolanowego otrzymano metodą
W brachyterapii MDR stosowane są dawki promieniowania
Koronarografia jest radiologicznym zabiegiem diagnostycznym pozwalającym ocenić drożność
Jaki kolor ma warstwa korowa kości w badaniu MR na obrazie T1- zależnym?
Do wczesnych odczynów popromiennych po radioterapii zalicza się
Pomiaru impedancji akustycznej ucha środkowego dokonuje się podczas badania