Pytanie 1
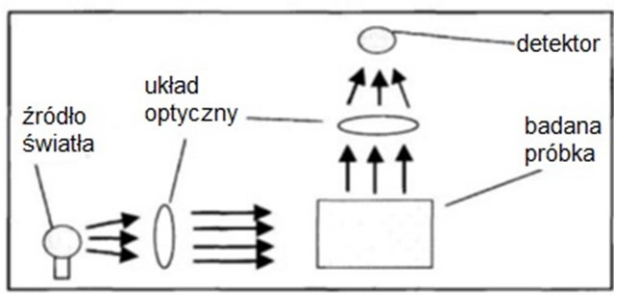
Na schemacie przedstawiono bieg promieni świetlnych
Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Na schemacie przedstawiono bieg promieni świetlnych

Na etykiecie odczynnika chemicznego zawarte są następujące informacje: Z informacji wynika, że odczynnik ten może być zastosowany do sporządzenia roztworu o stężeniu około 0,1 mol/dm3 z dokładnością do
| NH4SCN amonu tiocyjanian | 0,1 mol/dm3 |
| Stężenie po rozcieńczeniu do 1000 cm3 w 20°C | 0,1 mol/dm3 ± 0,2 % |
Woda pobrana do analizy mikrobiologicznej została rozcieńczona w proporcji 1:1000. Z uzyskanej mieszanki pobrano 0,1 ml, który następnie umieszczono na szalce z pożywką. Po hodowli na szalce zaobserwowano 10 jtk. Jakie było stężenie bakterii w analizowanej wodzie?
Po przeprowadzeniu procesu elektrolizy wodnego roztworu określonego związku, na katodzie pojawił się wodór, a na anodzie tlen. Który z tych związków został poddany elektrolizie?
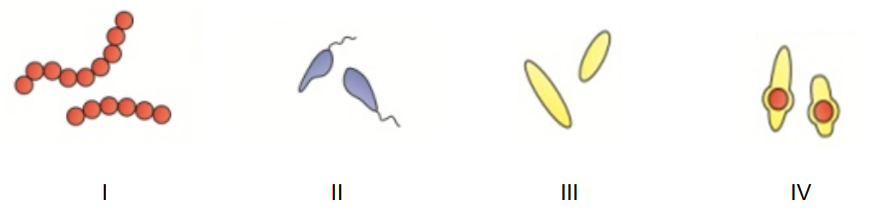
Które ilustracje przedstawiają formy cylindryczne bakterii?
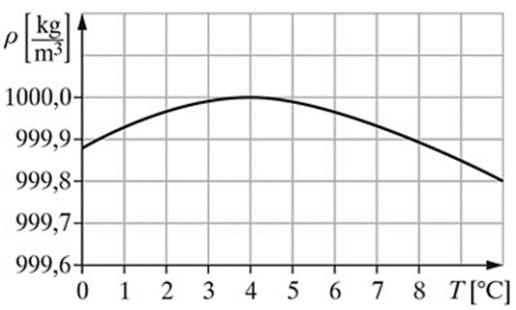
Na podstawie przedstawionego na rysunku wykresu zależności gęstości wody od temperatury, określ w jakiej temperaturze gęstość wody wynosi 1 g/cm3.
Jaką objętość rozcieńczalnika zużyto na przygotowanie wskazanego w opisie rozcieńczenia próbki mleka?
| Wykonać dziesiętne rozcieńczenia mleka z 10 cm3 próbki. Pierwsze rozcieńczenie wykonać w kolbie o pojemności 250 cm3: do 90 cm3 rozcieńczalnika dodać 10 cm3 próby, dokładnie wymieszać; z tego rozcieńczenia pobrać 0,5 cm3 i przenieść do 4,5 cm3 rozcieńczalnika. Postępować w ten sam sposób, aż do uzyskania rozcieńczenia 1:100000. |
W literaturze chromatografię określa się skrótem GC
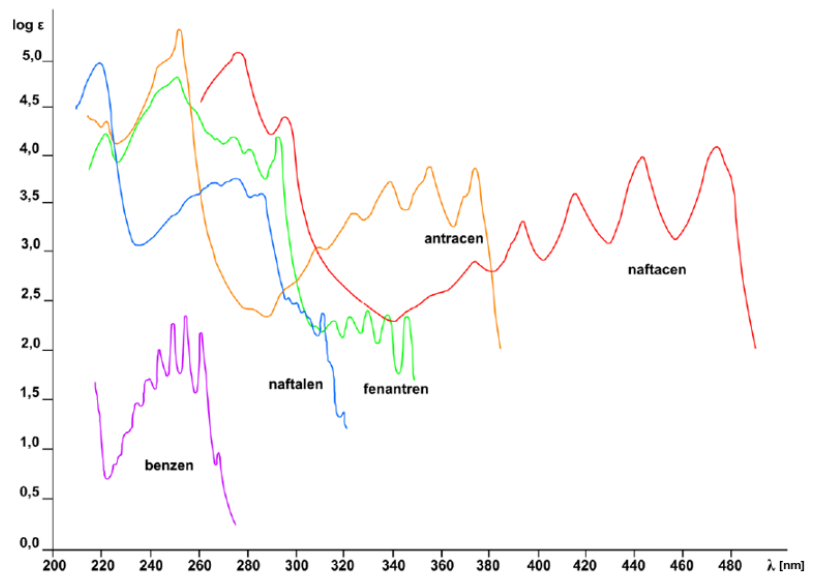
Który ze związków będzie barwny w świetle widzialnym?
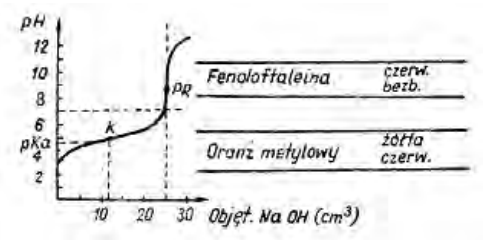
Zamieszczony wykres przedstawia krzywą miareczkowania
Elektroforeza to technika wykorzystywana głównie do segregacji mieszaniny
W tabeli przedstawiono charakterystykę
| |||||||||||||||
W wyniku oznaczenia wagowego otrzymano 0,2451 g tlenku żelaza(III). Ile gramów żelaza zawierała analizowana próbka?
| MFe = 55,845 g/mol, MO = 15,999 g/mol |
W tabeli przedstawiono wartości iloczynów rozpuszczalności wybranych siarczanów(VI).
| CaSO4 | 6,1·10-5 |
| SrSO4 | 2,8·10-7 |
| BaSO4 | 1,1·10-10 |
| PbSO4 | 2,2·10-8 |
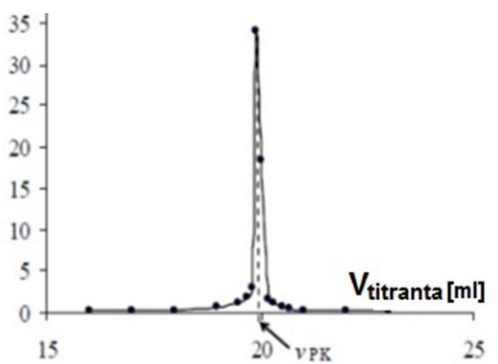
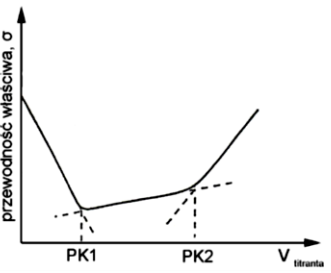
Sporządzono wykres potencjometrycznego miareczkowania alkacymetrycznego. W jaki sposób należy opisać oś Y?
| A. | ΔpH/ΔVtitranta |
| B. | ΔSEM/ΔVtitranta |
| C. | pH/ΔVtitranta |
| D. | SEM/ΔVtitranta |
Drobnoustroje posiadające zdolność do rozkładu białek oraz peptydów charakteryzują się właściwościami
Metodą, którą należy zastosować do bezpośredniego oznaczania jonów ołowiu w ekstrakcie z marchwi, jest
Rysunek przedstawia krzywą miareczkowania
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Dział analizy objętościowej, który dotyczy reakcji zobojętniania, to
W dwóch niezidentyfikowanych probówkach znajdują się roztwory: w jednej - glukozy, a w drugiej - sacharozy. Jakiego odczynnika należy użyć, aby rozpoznać glukozę?
Wśród substancji konserwujących stosowanych w żywności występują CH3COONH4 (E 264) oraz C6H5COONa (E 211). Związki te można określić jako
Wartość mnożnika analitycznego dla żelaza oznaczonego wagowo jako tlenek żelaza(III) wynosi
W próbce wody, w której stwierdzono obecność 60,0 mg żelaza, dokonano oznaczenia jego zawartości za pomocą spektrofotometrii, uzyskując wynik 59,1 mg. Jaki jest błąd względny tego oznaczenia?
Podczas ilościowego oznaczania zawartości chlorków w próbce wody zachodzą przemiany przedstawione równaniami reakcji: Wskaż typ reakcji, do którego należą.
| Ag+ + Cl- → AgCl |
| 2 Ag+ + CrO42- → Ag2CrO4 |
W wodzie poddawanej procesowi dezynfekcji mierzy się zawartość chloru wolnego. Co oznacza ten parametr?
Na ilustracji przedstawiono

Analizując dane zawarte w tabeli, można stwierdzić, że w smalcu w wyniku jełczenia
| Stadium jełczenia smalcu | Liczba jodowa, LJ | Liczba kwasowa, LK |
|---|---|---|
| Smalec świeży | 55,9 - 61,0 | 0,35 - 0,45 |
| Smalec zjełczały | 47,8 - 51,0 | 6,0 - 8,4 |
| Smalec silnie zjełczały | 31,9 - 41,1 | 26,0 - 30,0 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Oznaczono LZ i LJ dla czterech różnych próbek tłuszczów. Wyniki zestawiono w tabeli:
Na podstawie zamieszczonych danych o liczbach właściwych wybranych tłuszczów wskaż próbkę, którą stanowi olej rzepakowy.
| Liczby właściwe wybranych tłuszczów | ||
|---|---|---|
| Rodzaj tłuszczu | Liczba zmydlania (LZ) mg KOH / g tłuszczu | Liczba jodowa (LJ) g I₂ / 100 g tłuszczu |
| Olej lniany | 187 – 197 | 169 – 192 |
| Olej sojowy | 188 – 195 | 114 – 138 |
| Olej rzepakowy | 167 – 179 | 94 – 106 |
| Tran wielorybi | 170 – 202 | 102 – 144 |
| Masło krowie | 218 – 245 | 25 – 38 |
| Smalec wieprzowy | 193 – 200 | 46 – 66 |
| Próbka | Liczba zmydlania (LZ) | Liczba jodowa (LJ) |
|---|---|---|
| 1 | 190 | 140 |
| 2 | 171 | 99 |
| 3 | 194 | 105 |
| 4 | 195 | 60 |
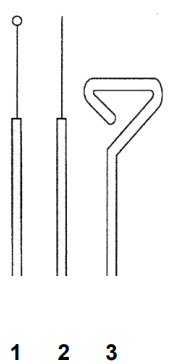
Wskaż nazwy sprzętów laboratoryjnych przedstawionych na rysunku.
Jaką wartość współmierności ma kolba miarowa o objętości 500 cm3 oraz pipeta jednomiarowa o objętości 20 cm3?
Jakim odczynnikiem grupowym IV grupy analitycznej kationów jest?
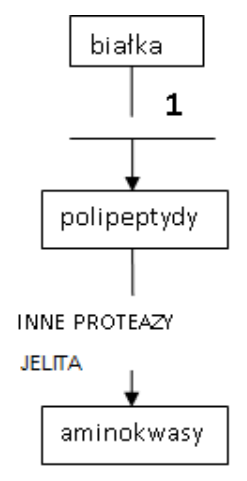
Na zamieszczonym schemacie trawienia białek cyfrą 1 oznaczono
Metoda analityczna, która polega na wyznaczaniu masy osadzonej substancji z roztworu z wykorzystaniem azotanu(V) srebra, to
W temperaturze 40°C lepkość oleju napędowego wynosi 3 mm2/s. Jakiego rodzaju lepkość to reprezentuje?
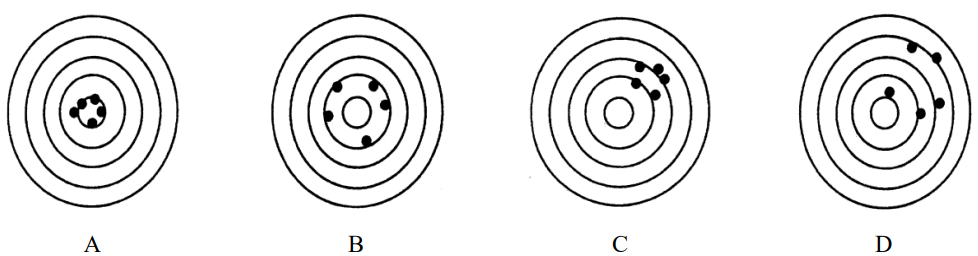
Na rysunkach przedstawiono serie pomiarów o różnej dokładności i precyzji (środek najmniejszego okręgu oznacza wartość prawdziwą). Serię pomiarów nieprecyzyjnych, ale dokładnych, przedstawiono na rysunku
Krzywa na rysunku obrazuje miareczkowanie

Z opisu wynika, że do oznaczenia wapnia w glukonianie wapnia stosuje się miareczkowanie
| Opis oznaczania zawartości wapnia w glukonianie wapnia |
|---|
| Oznaczenie polega na strąceniu jonów wapnia szczawianem amonu w postaci szczawianu wapnia CaC2O4 zgodnie z równaniem reakcji: Ca2+ + C2O42- → CaC2O4. Odsączony osad CaC2O4 rozpuszcza się w kwasie siarkowym(VI) zgodnie z równaniem reakcji: CaC2O4 + 2H+ → H2C2O4 + Ca2+ Wydzielony kwas szczawiowy, w ilości równoważnej ilości wapnia w próbce, odmiareczkowuje się mianowanym roztworem KMnO4. |
Jakie aspekty nie są objęte badaniami organoleptycznymi olejów rafinowanych?