Pytanie 1
Jakiego odczynnika użyć do wykrywania jonów chlorkowych w roztworze soli fizjologicznej?
Wynik: 26/40 punktów (65,0%)
Wymagane minimum: 20 punktów (50%)
Jakiego odczynnika użyć do wykrywania jonów chlorkowych w roztworze soli fizjologicznej?
Próbkę tłuszczu poddano analizie, której wyniki zapisano w tabeli. Która substancja była zawarta w próbce?
| Odczynnik | Obserwacje |
|---|---|
| woda bromowa | odbarwienie wody bromowej |
Jakie jest zastosowanie metody Winklera?
Jaką barwę ma oranż metylowy w środowisku o pH kwaśnym?
Który zestaw węglowodanów zalicza się do monosacharydów?
| mannoza | maltoza | mannoza | celuloza |
| glukoza | glukoza | glukoza | glukoza |
| sacharoza | fruktoza | fruktoza | ryboza |
| A | B | C | D |
W warunkach neutralnych manganian(VII) potasu ulega redukcji do
Ezy oraz igły stosowane w mikrobiologii należy wyjaławiać
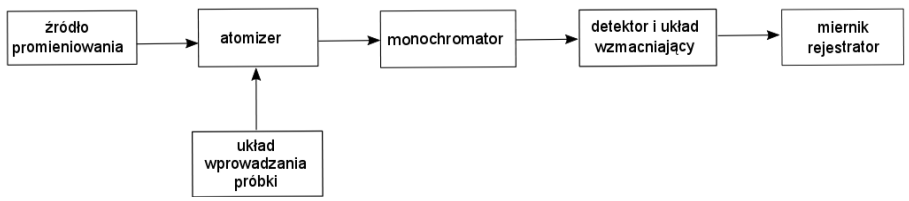
Na rysunku przedstawiono schemat blokowy
Przeprowadzono orientacyjną ocenę jakości mikrobiologicznej mleka w tak zwanej próbie azotanowej, która zabarwiła się na kolor bladoróżowy, co znaczy, że jakość mleka wziętego do analizy była
| Zabarwienie próbki mleka | Ocena jakości próbki Mleko: |
|---|---|
| bez zmiany barwy | bardzo dobre i dobre |
| lekko lub wyraźnie różowa | średniej jakości |
| intensywnie różowa, czerwona lub brunatna | złej jakości |
Czym są lipidy złożone?
Analiza, która opiera się na kontrolowanym wprowadzaniu roztworu o znanym stężeniu do badanego roztworu, to metoda oznaczeń ilościowych zwana
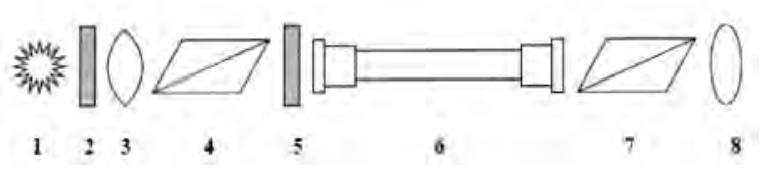
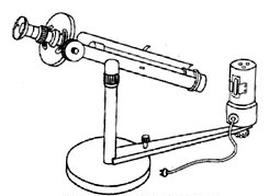
Na rysunku przedstawiającym schemat polarymetru, cyfrą 6 oznaczono
W kulturze bakterii i grzybów nie należy używać jako pożywki
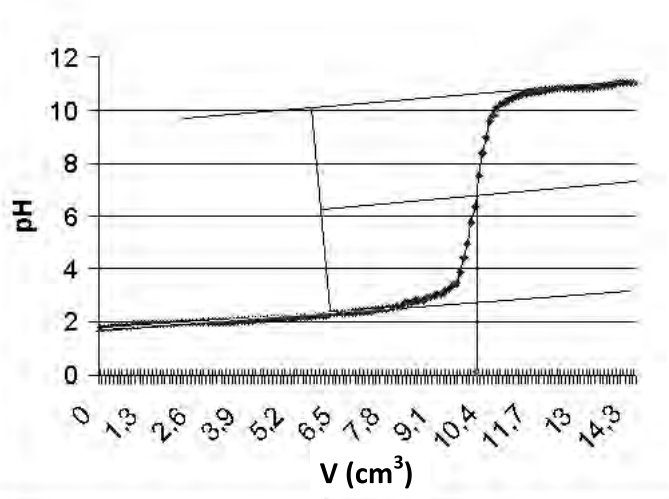
Przedstawioną na rysunku krzywą wyznaczono przy pomocy
W temperaturze 20°C wyznaczono gęstość i współczynnik załamania światła kwasu butanowego. Wyniki zestawiono w tabeli. Refrakcja molowa kwasu butanowego wynosi
| Gęstość | Współczynnik załamania światła |
|---|---|
| 0,960 g/cm³ | 1,398 |
| RM = n2 - 1 n2 + 2 M d |
| RM – refrakcja molowa, cm3/mol n – współczynnik załamania światła d – gęstość, g/cm3 M – masa molowa, 88 g/mol |
Wykonano jodometryczne oznaczenie zawartości kwasu askorbinowego dla 4 próbek tabletek witaminy C, uzyskując wyniki. Na podstawie informacji zawartych w opisie i wyników analizy można stwierdzić, że zawartość witaminy C
| Opis Na opakowaniach tabletek witaminy C producenci deklarują zawartość 200 mg kwasu askorbinowego. Zgodnie z normą odchylenia od deklarowanej zawartości substancji leczniczej nie mogą przekraczać ±10% dla tabletek o zawartości poniżej 100 mg i ±5% dla tabletek o deklarowanej zawartości 100 mg i więcej. | ||||
| Próbka | 1 | 2 | 3 | 4 |
| Zawartość kwasu askorbinowego | 198,5 mg | 211 mg | 201 mg | 205 mg |
Ilościowa analiza polegająca na dodawaniu równoważnej ilości roztworu odczynnika miareczkującego oraz precyzyjnym pomiarze jego objętości to analiza
Raport z analizy próbki wody nie zawiera
Eliminacja twardości wody w metodzie fizyko-chemicznej polega na użyciu
Jak określa się lepkość dynamiczną cieczy?
W jakim oznaczeniu wskaźnik reaguje z titrantem, prowadząc do powstania barwnego osadu?
Gdy pH próbki ścieków wynosi 3, to jakie jest stężenie jonów wodorowych?
Określ wartość opałową (Qi) węgla kamiennego, którego ciepło spalania jest równe 18752 J/g, zawartość popiołu wynosi 8,7%, zawartość wilgoci wynosi 4,1%.
| Qi = Qsp - 24,42 · (W + 8,94 · ZH) |
Qsp – ciepło spalania, J/g W – zawartość wilgoci, % 24,42 – ciepło parowania wody w temp. 25°C odpowiadające 1% wody w paliwie, J/g 8,94 – współczynnik przeliczenia wodoru na wodę, % ZH – zawartość wodoru w próbce paliwa, % Zawartość wodoru w próbce należy obliczyć z dokładnością do części dziesiątych ze wzoru: ZH = (100 - W - A) / 18,5 A – zawartość popiołu, % |
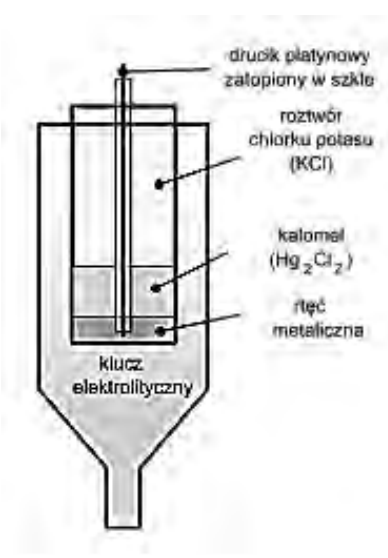
Na rysunku przedstawiono schemat elektrody
Wyznaczony roztwór tiocyjanianu amonu NH4SCN jest wykorzystywany jako titrant w badaniu bromków metodą miareczkowania?
Na podstawie przeprowadzonych badań wiadomo, że dany odczynnik chemiczny ma czystość równą 99,998%. Jak się go oznacza?
Na rysunku przedstawiono
Roztwór K2CrO4 jest używany jako wskaźnik przy oznaczaniu chlorków w metodzie Mohra. Powoduje on zmianę koloru mieszaniny reakcyjnej, co jest skutkiem
Jak należy ogrzewać probówkę z roztworem w trakcie wykrywania kationów II grupy analitycznej, gdy powstaje H2S?
Do kationów trzeciej grupy analitycznej, wytrącanych w formie siarczków roztworem AKT w środowisku amoniakalnym, należą:
| A. | Ni2+, Co2+, Fe2+, Fe3+, Mn2+, Zn2+ |
| B. | Mn2+, Cu2+, Cd2+, Cr3+, Ag+, Zn2+ |
| C. | Fe2+, Mg2+, Pb2+, Al3+, Ca2+ |
| D. | Ba2+, Ca2+, Sr2+ |
Jednym z kroków w procesie przygotowania preparatu mikrobiologicznego w stanie żywym jest
Amid kwasu tiooctowego to substancja chemiczna, która pod wpływem podgrzewania w warunkach kwasowych ulega hydrolizie. W analizach jakościowych może być stosowany zamiast substancji szkodliwej dla zdrowia
Przed każdym pomiarem pryzmaty refraktometru powinny być starannie oczyszczone
W wyniku pomiaru wagowego uzyskano 0,2451 g tlenku żelaza(III). Jaką masę żelaza zawierała badana próbka? MFₑ = 55,845 g/mol, MO = 15,999 g/mol?
W trakcie analiz mikrobiologicznych wody ze studni stwierdzono obecność bakterii rodzaju coli w ilości 200 bakterii/100 ml. To oznacza, że woda
Jaką metodą można ustalić ilość tłuszczów w produktach pochodzenia roślinnego?
Zawartość nadtlenków w oleju rzepakowym nie powinna przekraczać 5 milirównoważników aktywnego tlenu na 1 kg tłuszczu. Wartość ta, gdy jest wyższa, oznacza
Jaką metodę kontroli stanu mikrobiologicznego powietrza opisano w zamieszczonej informacji?
| Otwarte płytki Petriego z podłożem stałym pozostawiono na 30 minut na wysokości 1 metra od podłogi, a następnie inkubowano przez 48 godzin w temperaturze 37°C. Po tym czasie wyhodowane kolonie zliczono i zidentyfikowano ich szczepy. |
Rozpraszanie promieniowania świetlnego przez cząstki koloidalne, które mają wymiary mniejsze od długości fali światła, to zjawisko
Do czego używa się polarymetru?