Pytanie 1
Którą kasetę należy wykorzystać do wykonania rentgenogramu klatki piersiowej w projekcji bocznej u 35-letniej pacjentki o wzroście 165 cm i wadze 54 kg?
Wynik: 34/40 punktów (85,0%)
Wymagane minimum: 20 punktów (50%)
Którą kasetę należy wykorzystać do wykonania rentgenogramu klatki piersiowej w projekcji bocznej u 35-letniej pacjentki o wzroście 165 cm i wadze 54 kg?
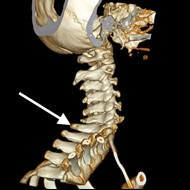
Na obrazie TK kręgosłupa strzałką wskazano wyrostek
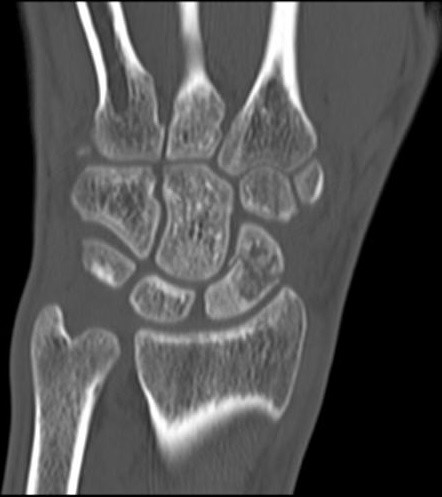
Na obrazie TK nadgarstka uwidocznione jest złamanie kości
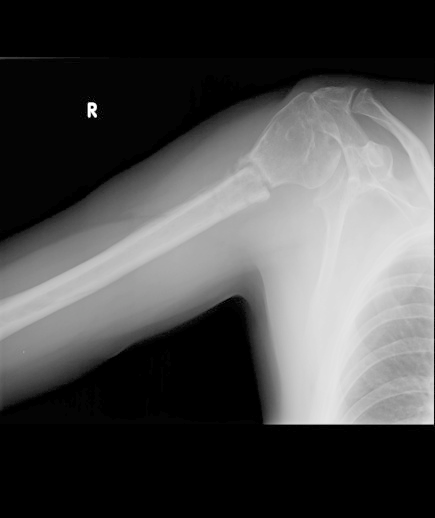
Na radiogramie uwidoczniono złamanie
Do zdjęcia rentgenowskiego żeber w projekcji skośnej tylnej pacjenta należy ustawić
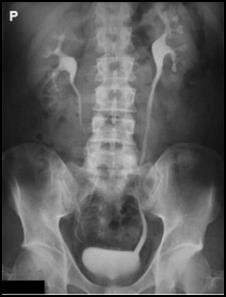
Zamieszczony rentgenogram został zarejestrowany podczas wykonania
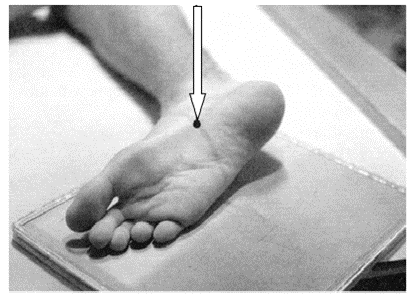
Na zamieszczonej ilustracji przedstawiono ułożenie pacjenta do wykonania zdjęcia rentgenowskiego
Po zakończeniu badania angiograficznego należy zapisać w dokumentacji medycznej pacjenta:
W której technice brachyterapii stosuje się źródła promieniowania o mocy dawki 2-12 Gy/h?
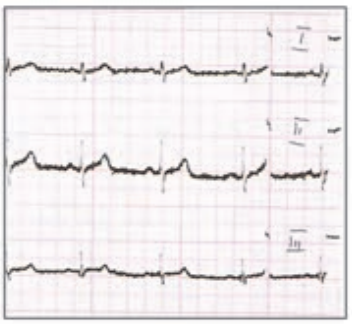
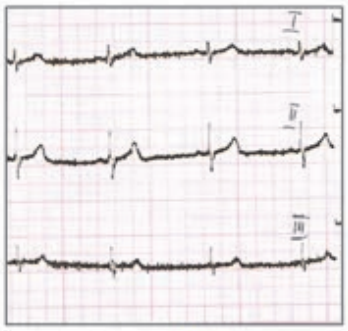
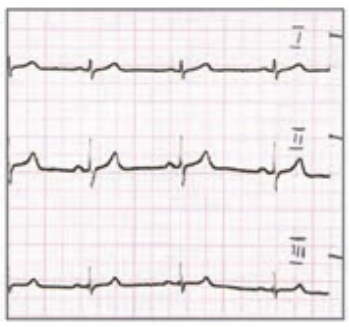
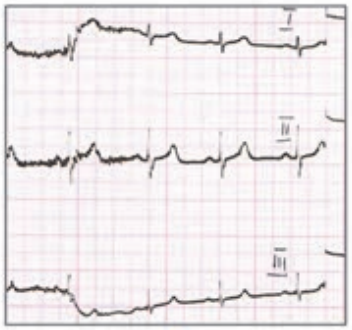
Który elektrokardiogram jest poprawny technicznie?
Który środek ochrony radiologicznej pacjenta należy zastosować podczas wykonywania zdjęcia bocznego kręgosłupa szyjnego?
W badaniu PET stosuje się tylko radioizotopy emitujące
Do zadań technika elektroradiologa w pracowni hemodynamicznej należy
Znak umieszczony w pracowni rezonansu magnetycznego zakazuje wstępu osobom

Elementem pomocniczym w radioterapii, zapewniającym powtarzalność ułożenia w pozycji terapeutycznej, a także unieruchomienie pacjenta, jest
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
Jaki czas należy ustawić do wykonania zdjęcia rentgenowskiego dwójki górnej lewej?
| Tabela ekspozycji | |||
|---|---|---|---|
| wartości | czasu (s) | napięcia (kV) | natężenia (mA) |
| zęby przedtrzonowe i kły | 0,160 | 60 | 8 |
| siekacze | 0,120 | 60 | 8 |
| zęby trzonowe | 0,200 | 60 | 8 |
| ekspozycja zgryzowo-skrzydełkowa | 0,180 | 66 | 6 |
Zastosowana w badaniu radiologicznym kratka przeciwrozproszeniowa powoduje
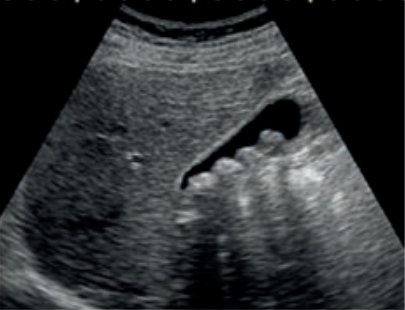
Jakie struktury anatomiczne uwidoczniono na obrazie USG?
Który radioizotop jest emiterem promieniowania alfa?
W standardowym badaniu elektrokardiograficznym elektrodę C4 należy umieścić
Do pomiaru dawek indywidualnych u osób narażonych zawodowo na promieniowanie rentgenowskie są stosowane
Które odprowadzenie w badaniu EKG rejestruje różnice potencjałów pomiędzy lewym a prawym przedramieniem?
Pomiaru impedancji akustycznej ucha środkowego dokonuje się podczas badania
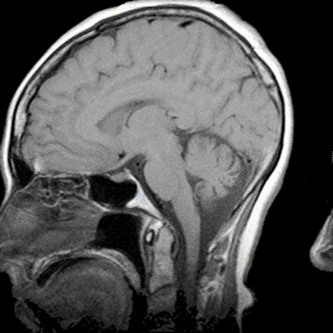
Który artefakt uwidoczniono na skanie RM głowy?
Radiogram przedstawia
Przy ułożeniu do zdjęcia kręgów szyjnych CIII-CVII w projekcji przednio-tylnej lampa może być odchylona o kąt
Które środki kontrastujące wykorzystywane są w diagnostyce rezonansem magnetycznym?
Która sekwencja obrazowania MR wykorzystuje impulsy RF o częstotliwości rezonansowej tłuszczu do tłumienia sygnału pochodzącego z tkanki tłuszczowej?
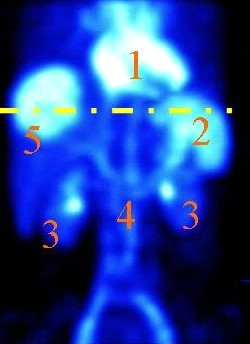
Który narząd na obrazie scyntygrafii znakowanej erytrocytami zaznaczono cyfrą 2?
Kiedy w procesie terapii wykonuje się badanie CBCT (cone beam computed tomography)?
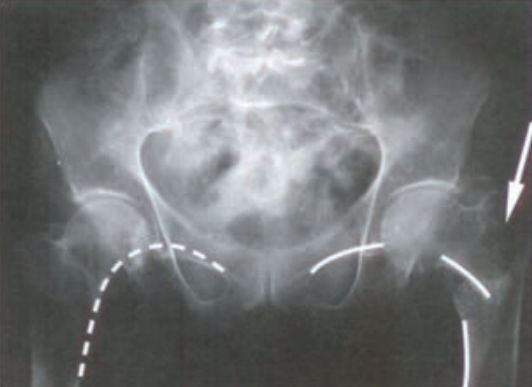
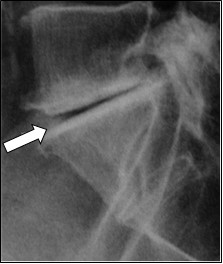
Na rentgenogramie strzałką zaznaczono
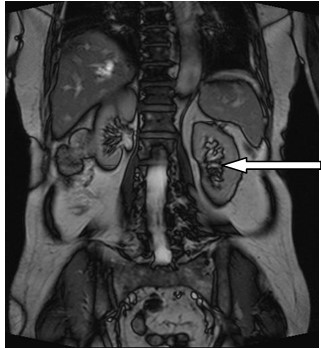
Który narząd został oznaczony strzałką na obrazie rezonansu magnetycznego?
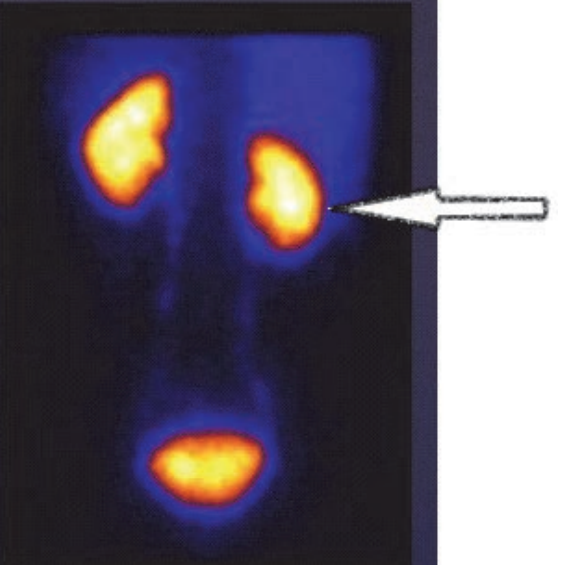
Na scyntygramie strzałką oznaczono
Wysoką rozdzielczość przestrzenną obrazowania MR uzyskuje się przez
Jak zgodnie ze standardem należy ustawić pacjenta do badania rentgenowskiego w skosie tylnym prawym?
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
Kolimator wielolistkowy w akceleratorze liniowym jest stosowany do
W obrazowaniu metodą rezonansu magnetycznego T1 oznacza czas