Pytanie 1
Jaki jest cel stosowania bolusa w radioterapii?
Wynik: 22/40 punktów (55,0%)
Wymagane minimum: 20 punktów (50%)
Jaki jest cel stosowania bolusa w radioterapii?
W jaki sposób należy ustawić promień centralny w stosunku do ramienia i przedramienia, by wykonać zdjęcie rentgenograficzne stawu łokciowego u pacjenta z przykurczem?
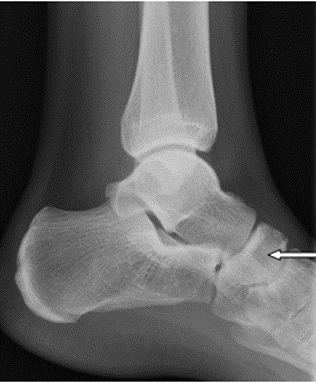
Na zamieszczonym radiogramie strzałką oznaczono kość
Zastosowana w badaniu radiologicznym kratka przeciwrozproszeniowa powoduje
W badaniu MR nadgarstka w ułożeniu na supermana pacjent leży na
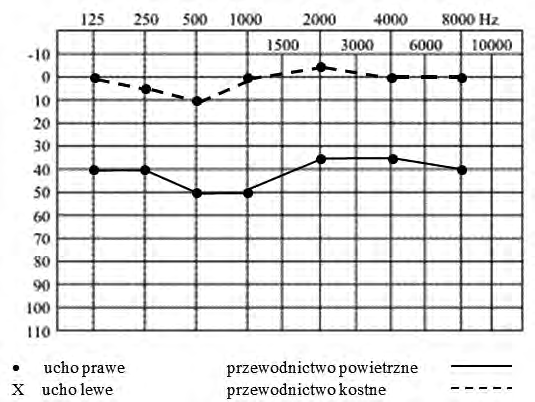
Na podstawie zapisu badania audiometrycznego rozpoznano u pacjenta uszkodzenie słuchu
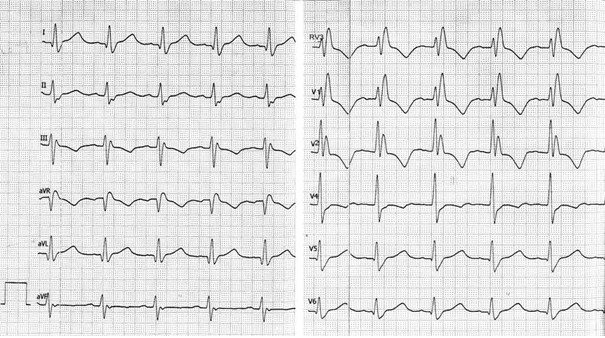
Przedstawiony zapis elektrokardiograficzny może wskazywać na
Radiofarmaceutyki stosowane w medycynie nuklearnej powstają dzięki połączeniu radioizotopu
W jaki sposób należy oprzeć stroik w audiometrycznym badaniu przewodnictwa kostnego?
Które obszary napromieniowania powinien określić lekarz radioterapeuta u pacjenta z nowotworem stercza po wcześniejszej prostatektomii?
W którym okresie ciąży wykonanie u kobiety zdjęcia rentgenowskiego klatki piersiowej jest najbardziej szkodliwe dla płodu?
Brachyterapia wewnątrzprzewodowa jest stosowana w leczeniu
Jak konwencjonalnie frakcjonuje się dawkę w teleradioterapii?
Który system informatyczny służy do archiwizacji i transmisji obrazów radiologicznych?
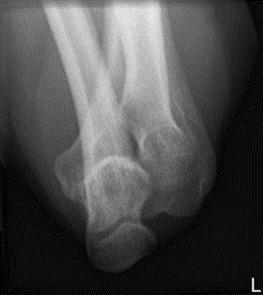
Którą strukturę anatomiczną i w jakiej projekcji uwidoczniono na radiogramie?
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
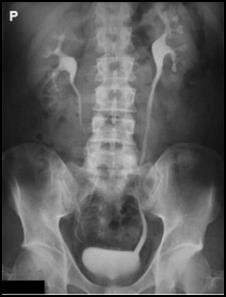
Zamieszczony rentgenogram został zarejestrowany podczas wykonania
Zgodnie z obowiązującymi przepisami powierzchnia gabinetu rentgenowskiego, w którym jest zainstalowany zestaw rentgenowski do badań naczyniowych, powinna wynosić
Koronarografia jest radiologicznym zabiegiem diagnostycznym pozwalającym ocenić drożność
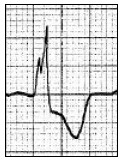
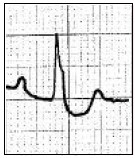
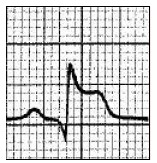
Który zapis EKG przedstawia falę Pardee'go?

Zdjęcie rentgenowskie nadgarstka w przywiedzeniu dołokciowym jest wykonywane w celu uwidocznienia kości
Cholangiografia to badanie radiologiczne
Przy podejrzeniu ciała obcego w oczodole należy wykonać
Rozpraszanie promieniowania X, w wyniku którego następuje zwiększenie długości fali promieniowania, to zjawisko
Który parametr ekspozycji ma decydujący wpływ na kontrast obrazu rentgenowskiego?
W pracowni radioterapii wyświetlenie na ekranie monitora aparatu komunikatu „ROTATION” oznacza prowadzoną terapię
Jaka jest odległość pomiędzy źródłem promieniowania a powierzchnią ciała pacjenta w technice izocentrycznej radioterapii?
Do czego służy do symulator rentgenowski wykorzystywany w procesie radioterapii?
W badaniu MR czas repetycji TR jest parametrem określającym odstęp czasu między
HRCT (high-resolution computed tomography) jest metodą obrazowania TK
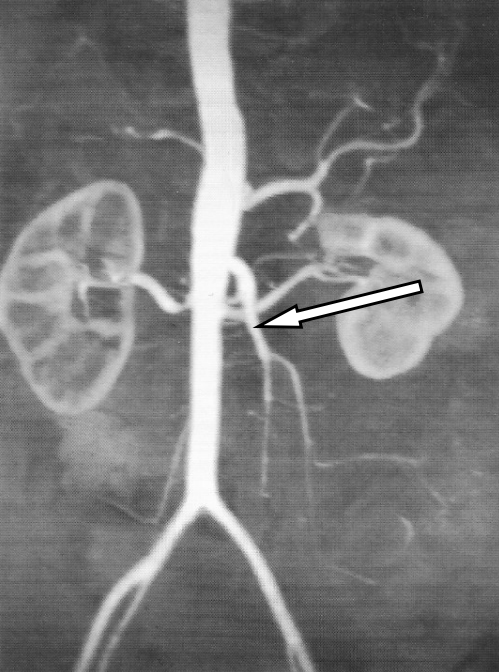
Którą tętnicę zaznaczono strzałką na obrazie MR?
Droga przewodnictwa powietrznego fali akustycznej przebiega przez
Na obrazie ultrasonograficznym jamy brzusznej uwidoczniono
W diagnostyce metodą rezonansu magnetycznego biorą udział
Który detektor w radiografii wymaga laserowego czytnika obrazu?
W jaki sposób należy ustawić promień centralny w stosunku do ramienia i przedramienia, by wykonać zdjęcie rentgenograficzne stawu łokciowego u pacjenta z przykurczem?
Urografia polega na
W medycznym przyspieszaczu liniowym jest generowana wiązka fotonów o energii w zakresie
Pielografia zstępująca umożliwia diagnostykę
Gdzie znajduje się węzeł zatokowo-przedsionkowy wywołujący rytmiczne skurcze mięśnia serca?