Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 21/40 punktów (52,5%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką metodę wykorzystuje się w laboratorium do rozdzielenia osadu AgCl od cieczy macierzystej w probówkach?
Aby otrzymać czystą substancję, próbka z nitroaniliną została poddana procesowi krystalizacji. Jaką masę nitroaniliny użyto do krystalizacji, jeśli uzyskano 1,5 g czystego związku, a wydajność krystalizacji wyniosła 75%?
Na rysunku przedstawiono
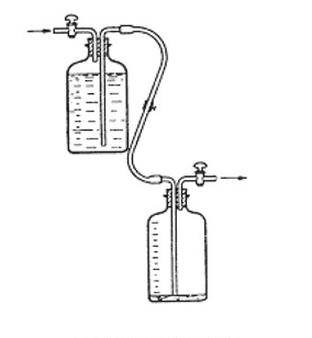
Aby przygotować miano kwasu solnego, konieczne jest odważenie węglanu sodu o masie wynoszącej około 400 mg. Jaką precyzję powinna mieć waga używana do odważenia węglanu sodu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zgodnie z zasadami BHP w laboratorium, po zakończeniu pracy z odczynnikami chemicznymi należy:
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakim kolorem zazwyczaj oznacza się przewody w instalacji gazowej w laboratorium?
Którego z poniższych naczyń laboratoryjnych nie powinno się używać do podgrzania 100 cm3wody?
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
Podczas pomiaru masy substancji w naczyniu wagowym na wadze technicznej, dla zrównoważenia masy na szalce zastosowano odważniki: 10 g, 5 g, 500 mg, 200 mg, 200 mg, 50 mg, 20 mg, 10 mg oraz 10 mg. Masa substancji razem z naczynkiem wyniosła
Które z poniższych działań należy wykonać przed rozpoczęciem pracy z nowym szkłem laboratoryjnym?
Jakie środki ochronne należy zastosować podczas sporządzania 1M roztworu zasady sodowej ze stężonego roztworu NaOH, na opakowaniu którego widnieje oznaczenie S/36/37/39?
| Numer zwrotu S | Warunki bezpiecznego stosowania |
|---|---|
| S36 | Używać odpowiedniej odzieży ochronnej |
| S37 | Używać odpowiednich rękawic |
| S38 | W przypadku niewystarczającej wentylacji używać sprzętu do oddychania |
| S39 | Używać okularów lub maski ochronnej |
Jakie jest stężenie procentowe roztworu uzyskanego poprzez rozpuszczenie 25 g jodku potasu w 100 cm3 destylowanej wody (o gęstości 1 g/cm3)?
Losowo należy pobierać próbki z opakowań
Dokonano pomiaru pH dwóch roztworów, uzyskując wartości pH= 2 oraz pH= 5. Wskaźnij poprawnie sformułowany wniosek.
W tabeli przedstawiono wymiary, jakie powinny mieć oznaczenia opakowań substancji niebezpiecznych.
Korzystając z informacji w tabeli, określ minimalne wymiary, jakie powinno mieć oznaczenie dla cysterny o pojemności 32840 dm3.
| Pojemność opakowania | Wymiary (w centymetrach) |
|---|---|
| Nieprzekraczająca 3 litrów | co najmniej 5,2 x 7,4 |
| Ponad 3 litry, ale nieprzekraczająca 50 litrów | co najmniej 7,4 x 10,5 |
| Ponad 50 litrów, ale nieprzekraczająca 500 litrów | co najmniej 10,5 x 14,8 |
| Ponad 500 litrów | co najmniej 14,8 x 21,0 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby oddzielić mieszankę etanolu i wody, konieczne jest przeprowadzenie procesu
W przypadku rozlania żrącego odczynnika chemicznego na skórę pierwszym poprawnym działaniem jest:
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
Na diagramie przedstawiającym proces pobierania prób środowiskowych do analizy literą Y oznaczono próbkę
Mianowanie roztworu KMnO4 następuje według poniższej procedury:
Około 0,2 g szczawianu sodu, ważonego z dokładnością ±0,1 mg, przenosi się do kolby stożkowej, rozpuszcza w około 100 cm3 wody destylowanej, następnie dodaje się 10 cm3 roztworu kwasu siarkowego(VI) i podgrzewa do temperatury około 70 °C. Miareczkowanie przeprowadza się roztworem KMnO4 do momentu uzyskania trwałego, jasnoróżowego koloru.
Powyższa procedura odnosi się do miareczkowania
Reagenty o najwyższej czystości to reagenty
Gęstość próbki cieczy wyznacza się przy użyciu
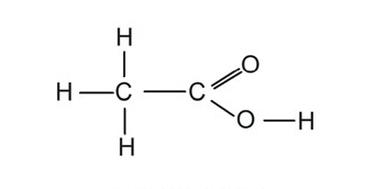
Związek o podanym wzorze to kwas
Do narzędzi pomiarowych zalicza się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Nie należy używać gorącej wody do mycia
Proces usuwania substancji z cieczy lub wydobywania składnika z mieszanin cieczy, oparty na równowadze fazowej ciecz-gaz, nazywa się
Do pojemników na odpady stałe, które są przeznaczone do utylizacji, nie można wprowadzać bezpośrednio cyjanków oraz związków kompleksowych zawierających jony cyjankowe z powodu
Wybierz spośród wymienionych właściwości tę, która nie dotyczy naczyń kwarcowych.
Która z metod pozwala na oddzielanie składników mieszaniny na podstawie różnic w ich zachowaniu w układzie składającym się z dwóch faz, z których jedna jest fazą stacjonarną, a druga porusza się w określonym kierunku względem niej?