Pytanie 1
Przy ułożeniu do zdjęcia AP czaszki płaszczyzna
Wynik: 40/40 punktów (100,0%)
Wymagane minimum: 20 punktów (50%)
Przy ułożeniu do zdjęcia AP czaszki płaszczyzna
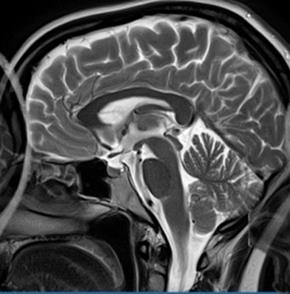
Wskaż przyczynę powstania artefaktu widocznego na obrazie MR.
Promieniowanie rentgenowskie jest
Którą strukturę anatomiczną oznaczono na obrazie rezonansu magnetycznego?
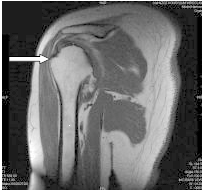
W leczeniu izotopowym tarczycy należy podać
Do zdjęcia prawych otworów międzykręgowych kręgosłupa szyjnego pacjent stoi w skosie
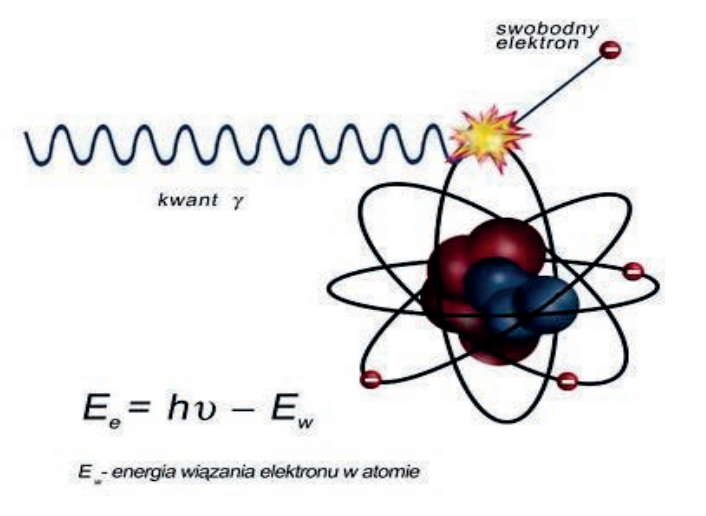
Diagnozowanie metodą PET oparte jest na zjawisku
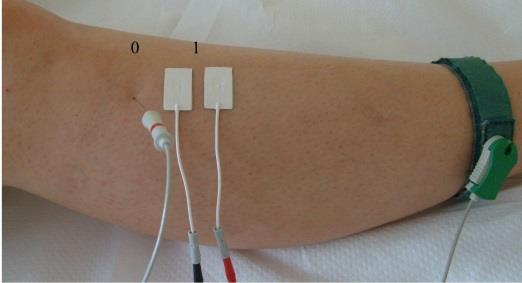
W badaniu EKG różnice potencjałów pomiędzy lewym podudziem a lewym przedramieniem rejestruje odprowadzenie
Gruboziarnista folia wzmacniająca wpływa na zwiększenie na obrazie rentgenowskim nieostrości
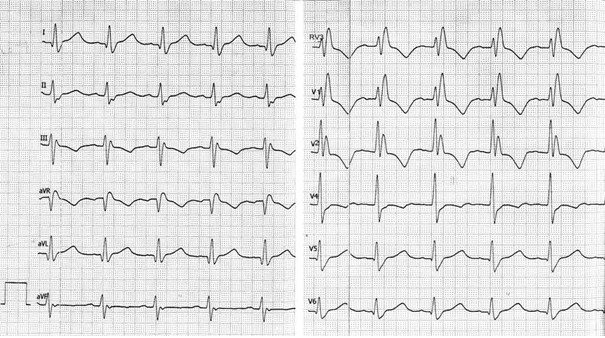
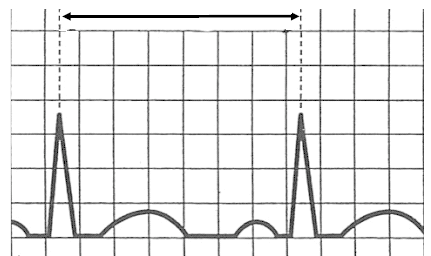
Zamieszczony elektrokardiogram przedstawia
Który parametr ekspozycji ma decydujący wpływ na kontrast obrazu rentgenowskiego?
Która struktura może być oknem akustycznym w badaniu ultrasonograficznym?
Na zamieszczonej rycinie przedstawiono
W jaki sposób należy ustawić promień centralny w stosunku do ramienia i przedramienia, by wykonać zdjęcie rentgenograficzne stawu łokciowego u pacjenta z przykurczem?
Droga przewodnictwa powietrznego fali akustycznej przebiega przez
Na ilustracji przedstawiono przygotowanie pacjenta do badania
Powierzchnia gabinetu rentgenowskiego, w którym zainstalowany jest aparat rentgenowski wyposażony w oddzielną lampę, nie może być mniejsza niż
Który załamek odzwierciedla repolaryzację komór w zapisie EKG?
W jaki sposób należy oprzeć stroik w audiometrycznym badaniu przewodnictwa kostnego?
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
Na schemacie oznaczono
W technice napromieniania SSD mierzona jest odległość źródła promieniowania od
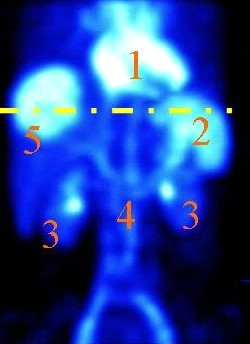
Który narząd na obrazie scyntygrafii znakowanej erytrocytami zaznaczono cyfrą 2?
Który system informatyczny służy do archiwizacji i transmisji obrazów radiologicznych?
Na którym obrazie rentgenowskim sutka uwidoczniono zmianę patologiczną w obrębie węzłów chłonnych?
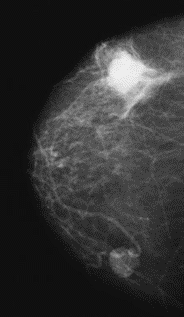
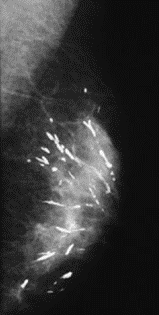
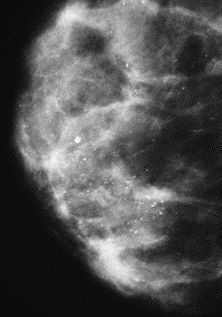
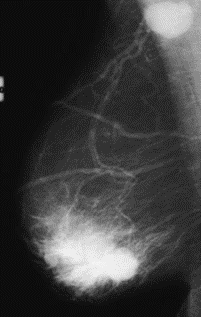
Do pomiaru dawek indywidualnych u osób narażonych zawodowo na promieniowanie rentgenowskie są stosowane
Który obszar napromieniania wskazano na ilustracji strzałką?
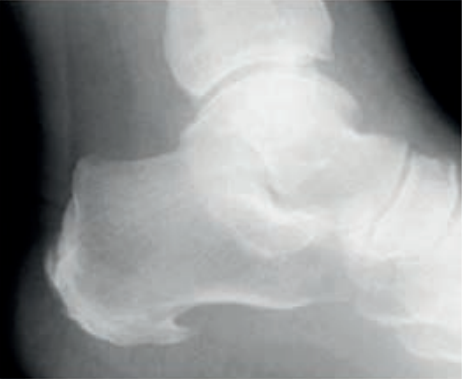
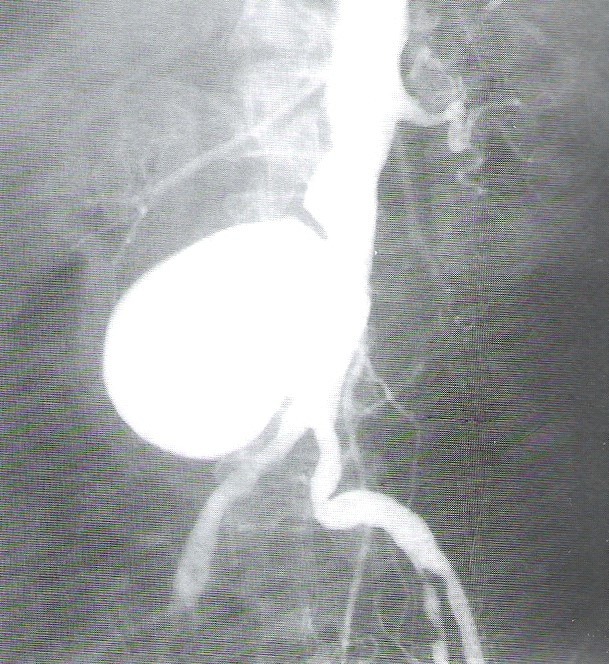
Co zostało uwidocznione na zamieszczonym radiogramie?
Obrazowanie w sekwencjach STIR, FLAIR, SE wykonywane jest w badaniu
Przyczyną zaniku kostnego jest
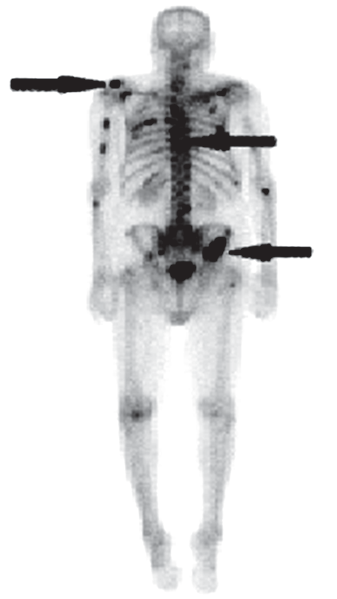
Na scyntygramie kości strzałkami oznaczono ogniska
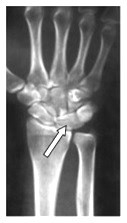
Na obrazie radiologicznym nadgarstka strzałką zaznaczona jest kość
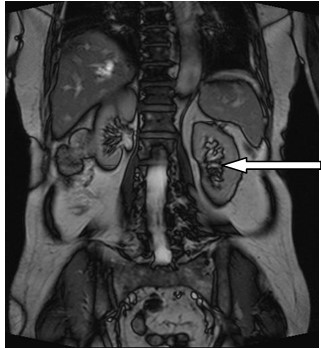
Który narząd został oznaczony strzałką na obrazie rezonansu magnetycznego?
Jaka jest moc dawki pochłoniętej w brachyterapii HDR?
Na prawidłowo wykonanym zdjęciu zatok w projekcji PA górny zarys piramid rzutuje się
Które ciało obce w obszarze badania nie stanowi przeciwwskazania do wykonania MR?
Jak określa się rekonstrukcję obrazów TK, której wynikiem są obrazy dwuwymiarowe tworzone w dowolnej płaszczyźnie przez wtórną obróbkę zestawionych ze sobą wielu przekrojów poprzecznych?
Na obrazie rentgenowskim strzałką zaznaczono
Który radiofarmaceutyk może zostać podany pacjentowi w scyntygrafii perfuzyjnej mózgu?
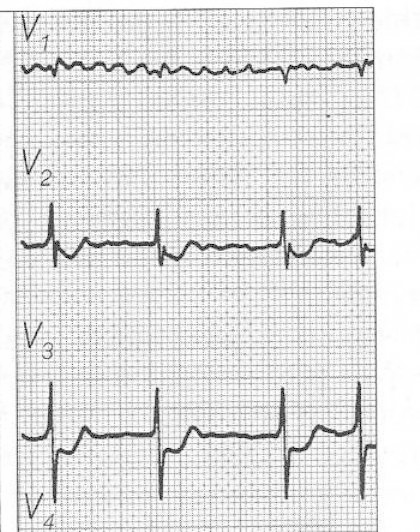
Przedstawiony zapis elektrokardiograficzny może wskazywać na