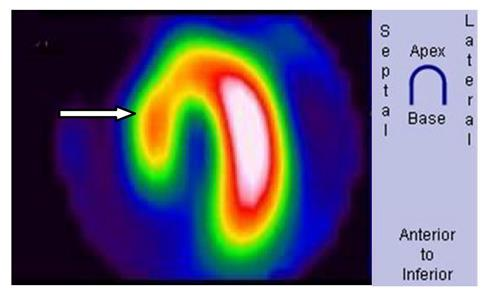
Pytanie 1
Przedstawiony obraz został zarejestrowany podczas wykonania
Wynik: 31/40 punktów (77,5%)
Wymagane minimum: 20 punktów (50%)
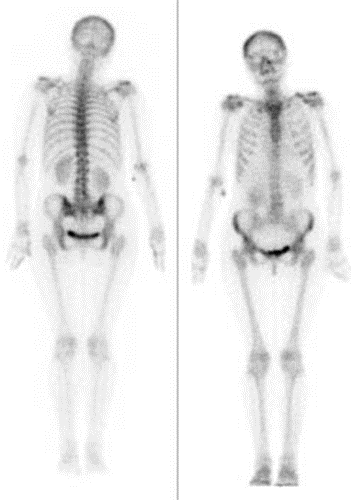
Przedstawiony obraz został zarejestrowany podczas wykonania

W pozytonowej tomografii emisyjnej PET zostaje zarejestrowane promieniowanie powstające podczas
Na zarejestrowanych obrazach badania renoscyntygraficznego widać, że prawa nerka pacjenta
Który narząd został uwidoczniony na przedstawionym obrazie scyntygraficznym?
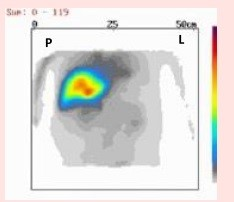
Na obrazie uwidoczniono
Kto jest odpowiedzialny za wykonywanie testów podstawowych kontroli jakości gammakamery w Zakładzie Medycyny Nuklearnej?
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
W scyntygrafii perfuzyjnej płuc pacjentowi podawany jest radioizotop
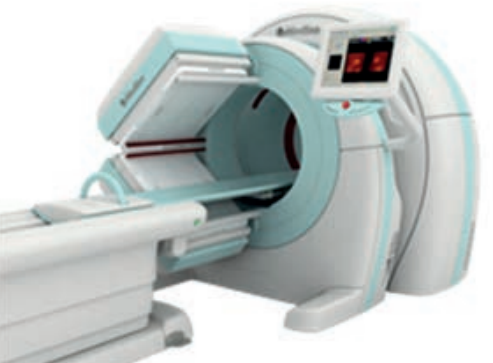
Które urządzenie zostało przedstawione na fotografii i w jakiej pracowni znajduje zastosowanie?
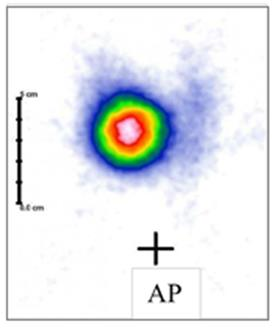
Na scyntygramie tarczycy został uwidoczniony guzek
W badaniu PETCT radioizotop ulega
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
Który radioizotop jest stosowany w diagnostyce i terapii raka tarczycy?
Diagnozowanie metodą PET oparte jest na zjawisku
W leczeniu izotopowym tarczycy należy podać
Które czynności wykonuje technik elektroradiolog w pracowni „gorącej”?
Wskazaniem do wykonania scyntygrafii perfuzyjnej jest
Ligand stosuje się
Który radiofarmaceutyk może zostać podany pacjentowi w scyntygrafii perfuzyjnej mózgu?
W badaniu PET CT wykorzystuje się radioizotopy emitujące promieniowanie
W medycynie nuklearnej wykorzystuje się:
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
Radioizotopowa terapia medycyny nuklearnej polega na wprowadzeniu do tkanek lub narządów radiofarmaceutyku
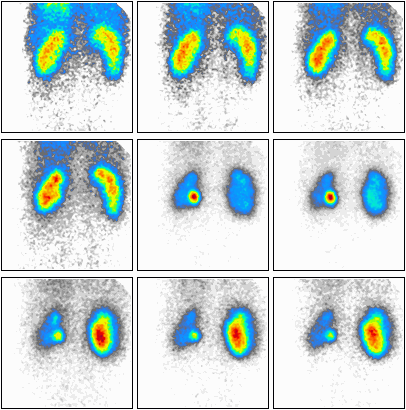
Na którym obrazie zarejestrowano badanie scyntygraficzne?
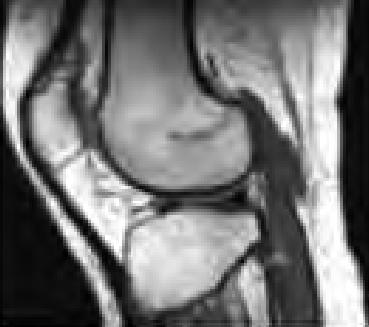
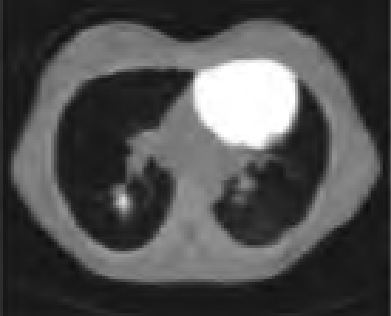
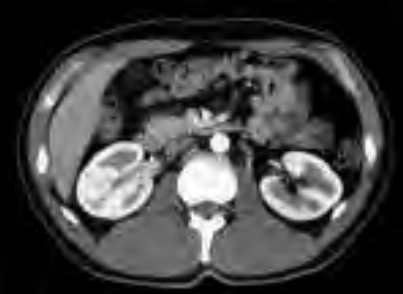
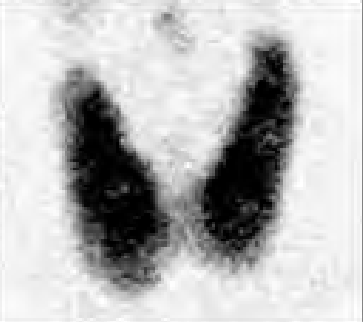
Który radioizotop jest emiterem promieniowania alfa?
W leczeniu izotopowym tarczycy podaje się
Który radiofarmaceutyk należy podać pacjentowi w scyntygrafii perfuzyjnej mózgu?
„Ognisko zimne” w obrazie scyntygraficznym oznacza
Czas połowicznego zaniku jest wykorzystywany
W której technice obrazowania zostają zarejestrowane jednocześnie dwa przeciwbieżne kwanty promieniowania gamma o równej energii 511 keV?
Którym skrótem oznacza się tomografię komputerową wysokiej rozdzielczości?
Glukoza podawana pacjentowi w badaniu PET jest znakowana radioaktywnym
W scyntygrafii kośćca „ogniska gorące” oznaczają miejsca
Który radioizotop jest stosowany w scyntygrafii perfuzyjnej mózgu?
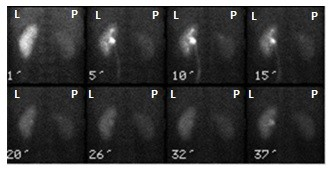
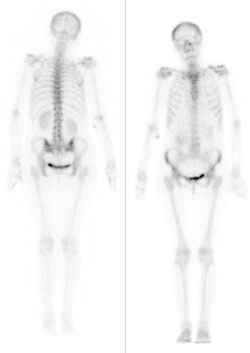
Przedstawiony obraz został zarejestrowany podczas wykonywania
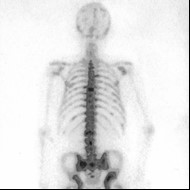
Podczas którego badania zostały zarejestrowane przedstawione obrazy?
Które informacje należy zamieścić na strzykawce z radiofarmaceutykiem przygotowanym przez technika elektroradiologa?
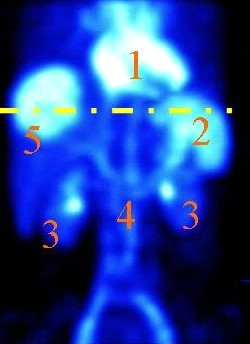
Który narząd na obrazie scyntygrafii znakowanej erytrocytami zaznaczono cyfrą 2?
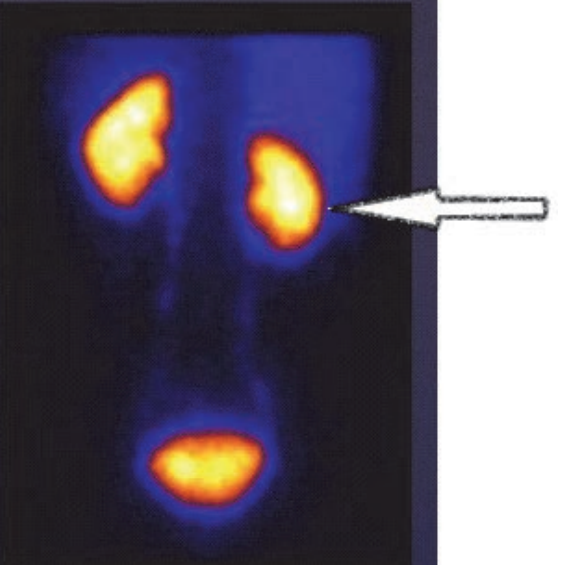
Na scyntygramie strzałką oznaczono
Na obrazie scyntygrafii perfuzyjnej serca strzałką wskazano ścianę