Pytanie 1
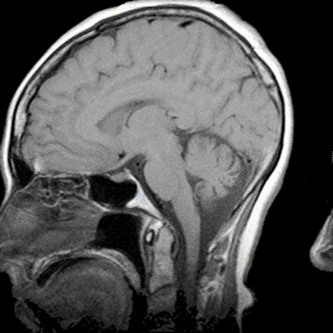
Który artefakt uwidoczniono na skanie RM głowy?
Wynik: 34/40 punktów (85,0%)
Wymagane minimum: 20 punktów (50%)
Który artefakt uwidoczniono na skanie RM głowy?

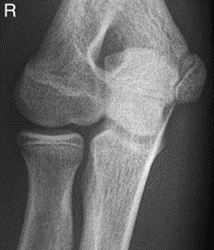
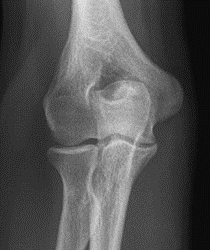
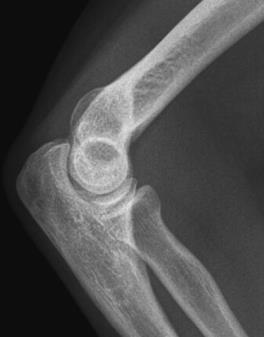
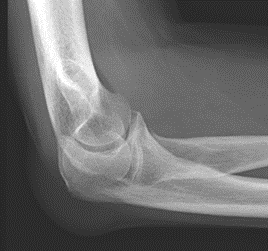
Które zdjęcie RTG stawu łokciowego zostało wykonane w projekcji skośnej w rotacji zewnętrznej?
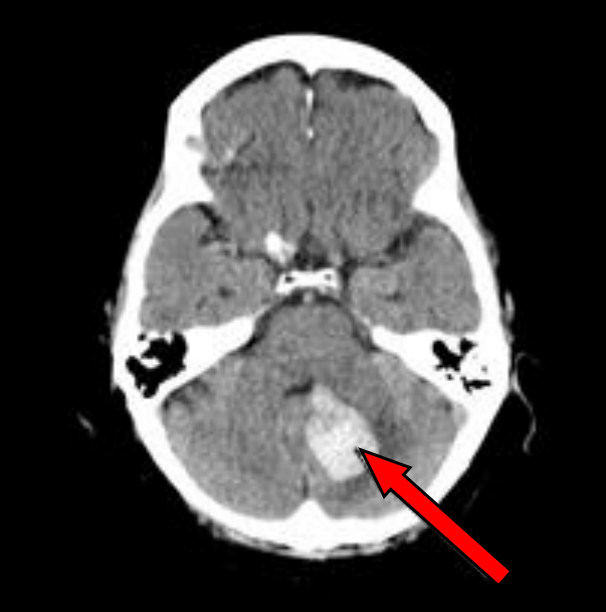
Na przekroju poprzecznym TK mózgu strzałką wskazano obszar
Standardowe badanie USG średniej wielkości piersi wykonuje się głowicą w zakresie częstotliwości
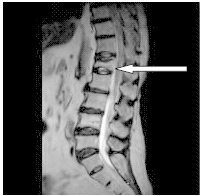
Na obrazie rezonansu magnetycznego strzałką oznaczono patologiczny kręg
Badanie polegające na wprowadzeniu cewnika przez pęcherz moczowy do moczowodu i miedniczki nerkowej i podaniu środka kontrastującego to
W lampie rentgenowskiej promieniowanie X powstaje w wyniku hamowania
Podczas teleradioterapii piersi lewej narządem krytycznym jest
Jak przebiega promień centralny w projekcji AP czaszki?
Hałas podczas badania tomografii rezonansu magnetycznego jest efektem ubocznym pracy
Na radiogramie strzałką oznaczono
Podczas wykonywania badania EKG czarną elektrodę kończynową należy umieścić na kończynie dolnej
Który radioizotop jest emiterem promieniowania alfa?
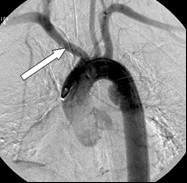
Na obrazie cyfrowej angiografii subtrakcyjnej strzałką zaznaczono
W badaniu EKG odprowadzenie I rejestruje różnicę potencjałów między
Które czynności wykonuje technik elektroradiolog w pracowni „gorącej”?
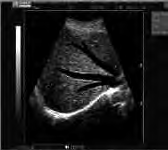
Na obrazie ultrasonograficznym jamy brzusznej uwidoczniono
Zdjęcie rentgenowskie nadgarstka w przywiedzeniu dołokciowym jest wykonywane w celu uwidocznienia kości
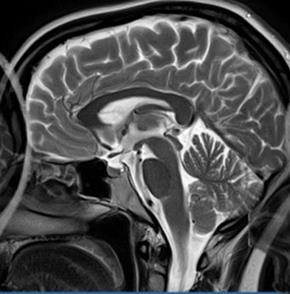
Która przyczyna spowodowała powstanie artefaktu widocznego na zamieszczonym obrazie MR?
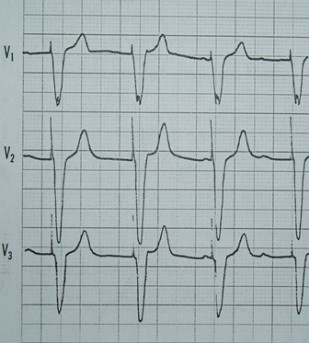
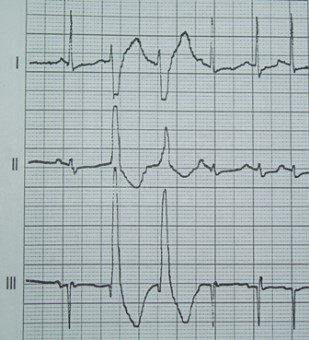
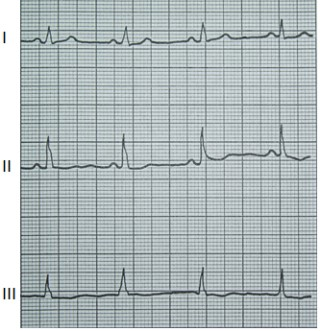
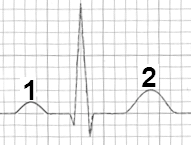
Na którym z zapisów EKG została uwidoczniona fala Pardee'go?
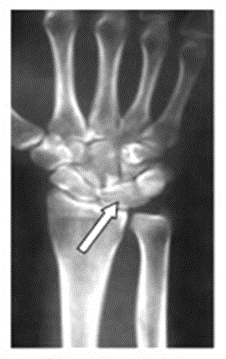
Na zamieszczonym obrazie radiologicznym nadgarstka strzałką wskazano kość
Brachyterapia polega na napromieniowaniu pacjenta promieniowaniem
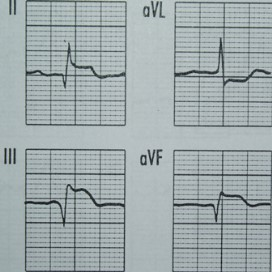
Który załamek w zapisie EKG odpowiada zjawisku depolaryzacji przedsionków mięśnia sercowego?
Jaki kolor ma warstwa korowa kości w badaniu MR na obrazie T1- zależnym?
Kiedy w procesie terapii wykonuje się badanie CBCT (cone beam computed tomography)?
Która składowa prawidłowej krzywej EKG odpowiada powolnej repolaryzacji komór mięśnia sercowego?
Jakie są wielkości mocy dawki stosowanej w brachyterapii HDR?
W jakiej pozycji układa się pacjenta do standardowego badania MR kręgosłupa szyjnego?
Do zdjęcia prawych otworów międzykręgowych kręgosłupa szyjnego pacjent stoi w skosie
Dobierz dla standardowego pacjenta projekcję, pozycję i sposób ułożenia kasety o wymiarach 30 cm × 40 cm do zdjęcia przeglądowego układu moczowego.
| Projekcja | Pozycja | Ułożenie kasety | |||
|---|---|---|---|---|---|
| 1. | AP | 3. | stojąca | 5. | poprzeczne |
| 2. | PA | 4. | leżąca | 6. | podłużne |
Do prób aktywacyjnych stosowanych w badaniu EEG zalicza się
Fala głosowa rozchodzi się
Cholangiografia to badanie radiologiczne
Na schemacie oznaczono
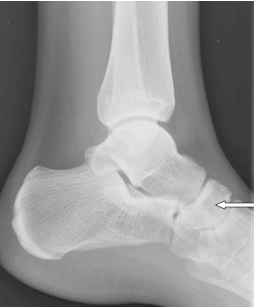
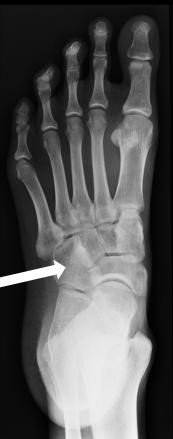
Którą kość zaznaczono strzałką na radiogramie stopy?
Standardowe badanie urografii polega na podaniu pacjentowi środka kontrastującego
Jak określa się rekonstrukcję obrazów TK, której wynikiem są obrazy dwuwymiarowe tworzone w dowolnej płaszczyźnie przez wtórną obróbkę zestawionych ze sobą wielu przekrojów poprzecznych?
Warstwa półchłonna (WP) służy do obliczania
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
Do zdjęcia lewobocznego kręgosłupa lędźwiowo-krzyżowego pacjenta należy ułożyć na boku