Pytanie 1
Najczęściej używaną metodą w oznaczeniach spektrofotometrycznych jest technika krzywej wzorcowej. Jeżeli pomiar jest przeprowadzany w odniesieniu do próby ślepej, to krzywa wzorcowa powinna przechodzić przez
Wynik: 19/40 punktów (47,5%)
Wymagane minimum: 20 punktów (50%)
Najczęściej używaną metodą w oznaczeniach spektrofotometrycznych jest technika krzywej wzorcowej. Jeżeli pomiar jest przeprowadzany w odniesieniu do próby ślepej, to krzywa wzorcowa powinna przechodzić przez
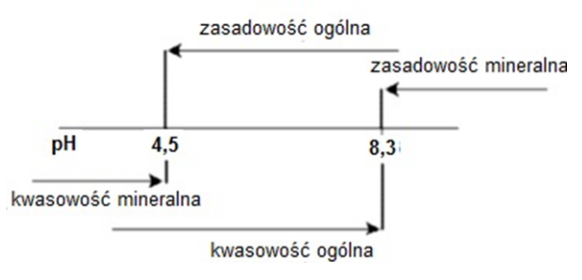
Na schemacie przedstawiono zakres występowania kwasowości i zasadowości w wodach naturalnych w zależności od pH. Dla wody o pH = 4,1 należy wykonać badanie
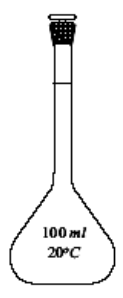
Jaką wartość współmierności ma kolba miarowa o objętości 500 cm3 oraz pipeta jednomiarowa o objętości 20 cm3?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
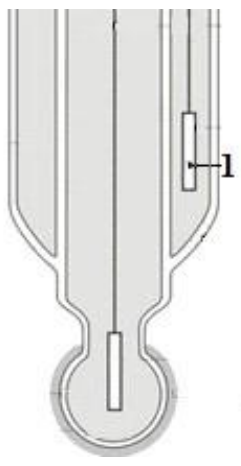
Na rysunku przedstawiono schemat szklanej elektrody zespolonej. Cyfrą 1 oznaczono
Wskaż, w jakim rodzaju analizy stosowany jest sprzęt przedstawiony na rysunku.
Z opisu wynika, że do oznaczenia wapnia w glukonianie wapnia stosuje się miareczkowanie
| Opis oznaczania zawartości wapnia w glukonianie wapnia |
|---|
| Oznaczenie polega na strąceniu jonów wapnia szczawianem amonu w postaci szczawianu wapnia CaC2O4 zgodnie z równaniem reakcji: Ca2+ + C2O42- → CaC2O4. Odsączony osad CaC2O4 rozpuszcza się w kwasie siarkowym(VI) zgodnie z równaniem reakcji: CaC2O4 + 2H+ → H2C2O4 + Ca2+ Wydzielony kwas szczawiowy, w ilości równoważnej ilości wapnia w próbce, odmiareczkowuje się mianowanym roztworem KMnO4. |
Rysunek przedstawia
Określenie miedzi w postaci czystego osadu pierwiastka przeprowadza się w trakcie analizy
Przy pomocy zamieszczonego na rysunku urządzenia można oznaczyć
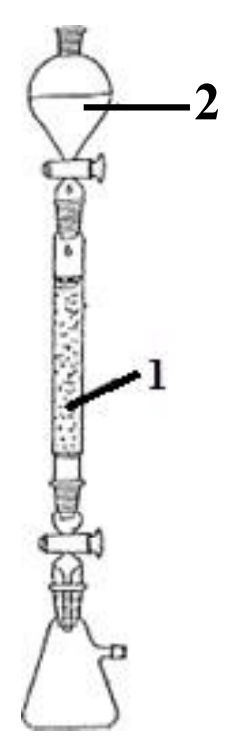
Jeżeli przewodnictwo właściwe wody destylowanej mieści się w granicach 0,1•10-4 do 1•10-4 mS/cm, to do pomiarów należy zastosować czujnik konduktometryczny o wartości stałej naczynka K równej

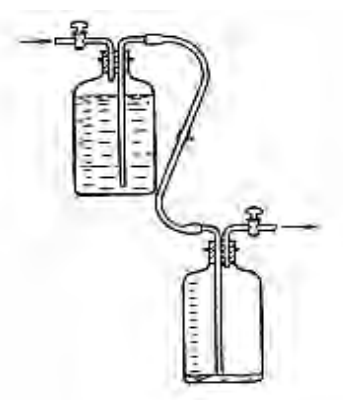
Na rysunku przedstawiono zestaw do chromatografii kolumnowej. Cyfrą 1 oznaczono
Wielkość określająca zmienność wyników przy wielokrotnym pomiarze tego samego składnika tą samą metodą nosi nazwę
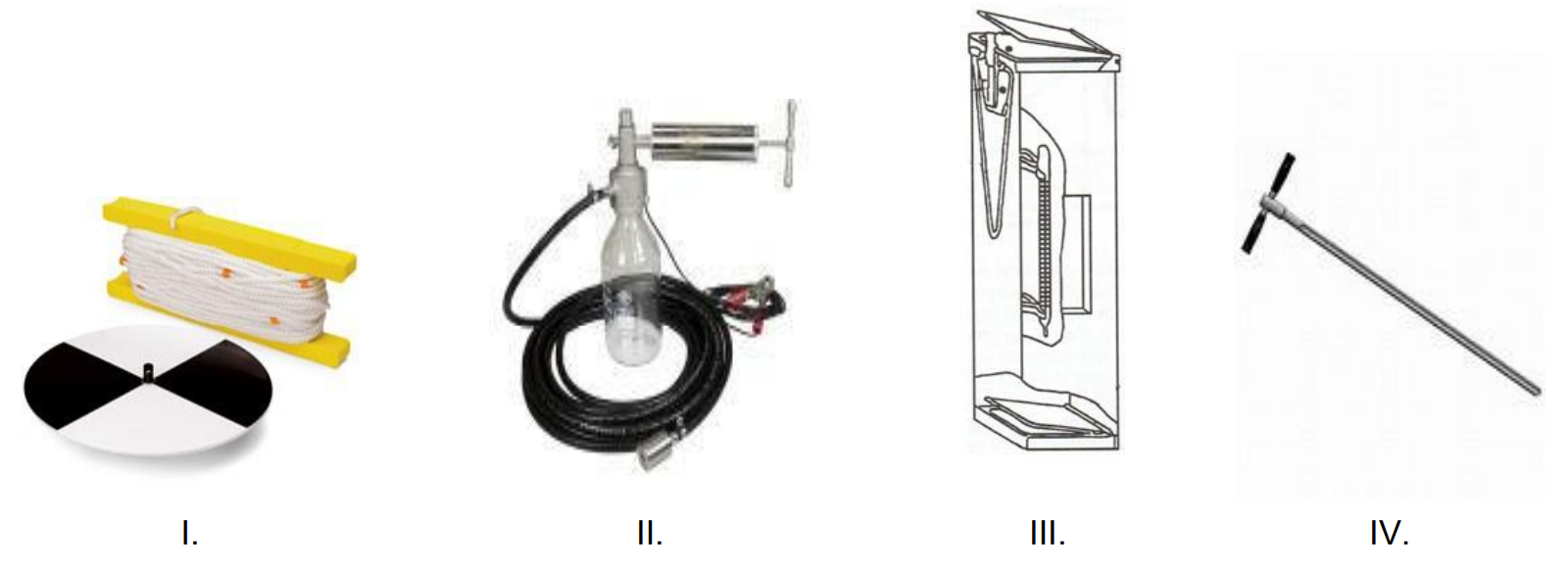
Na którym rysunku przedstawiono sprzęt stosowany do pomiaru mętności wody?
W celu identyfikacji czterech próbek cukrów zbadano ich skręcalność właściwą. Błąd systematyczny pomiaru wynosił + 10%. Wynik próbki pierwszej to + 57,8°. Na podstawie danych zawartych w tabeli można stwierdzić, że badanym cukrem jest
| Skręcalność właściwa roztworów niektórych związków optycznie czynnych (w temp. 20°C) | ||
|---|---|---|
| Substancja | Rozpuszczalnik | Skręcalność właściwa |
| Sacharoza | Woda | + 66,5° |
| Glukoza | Woda | + 52,5° |
| Fruktoza | Woda | + 93,0° |
| Maltoza | Woda | + 136,9° |
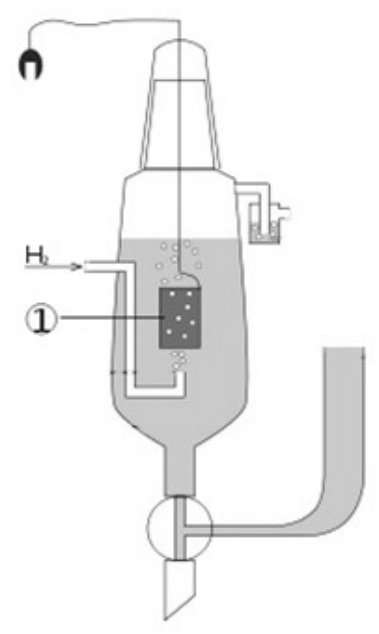
Na schemacie przedstawiającym elektrodę wodorową, cyfrą 1 oznaczono
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Badanie szczegółowej struktury komórek roślinnych oraz zwierzęcych, jak również rozmieszczenia atomów w kryształach metali i minerałów, jest możliwe dzięki wykorzystaniu mikroskopu
Jakie urządzenie należy wykorzystać do określenia temperatury wrzenia cieczy?
Liczba wskazująca ilość (w mg) KOH potrzebną do zneutralizowania wolnych kwasów tłuszczowych obecnych w badanym tłuszczu, to liczba
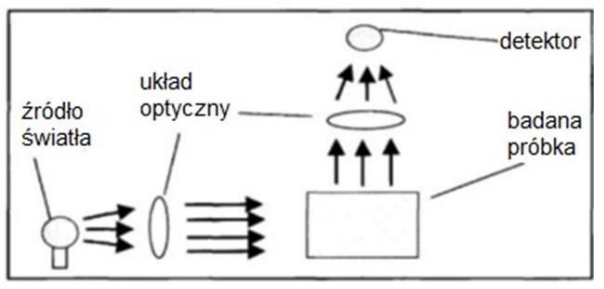
Na ilustracji przedstawiono bieg promieni świetlnych
Biocydy wprowadza się do próbki środowiskowej w celu
Na jakiej pożywce wykonuje się posiew kłuty preparatu mikrobiologicznego?
Szkło wodne sodowe jest roztworem krzemianów sodu o wzorze Na2O • nSiO2 Zawartość tlenków sodu i krzemu wpływa na tzw. moduł molowy M
| M = B/A·1,032 | A - zawartość tlenku sodu, [%] B - zawartość krzemionki, [%] 1,032 - współczynnik przeliczeniowy z jednostek wagowych na mole |
| Wymagania | Rodzaj R | |||
|---|---|---|---|---|
| R - 150-1.7 | R - 150S | R - 150-2.3 | R - 149 | |
| Moduł molowy SiO2/Na2O | 1,65 ÷ 1,85 | 2,2 ÷ 2,4 | 2,3 ÷ 2,4 | 2,8 ÷ 3,0 |
Przed każdym pomiarem pryzmaty refraktometru powinny być starannie oczyszczone
Błąd pomiarowy, który stanowi różnicę pomiędzy średnim wynikiem pomiaru a wartością rzeczywistą, określa się mianem
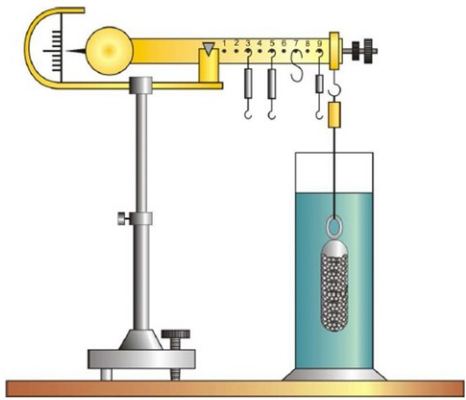
Przedstawiona na rysunku waga Westphala-Mohra służy do badania
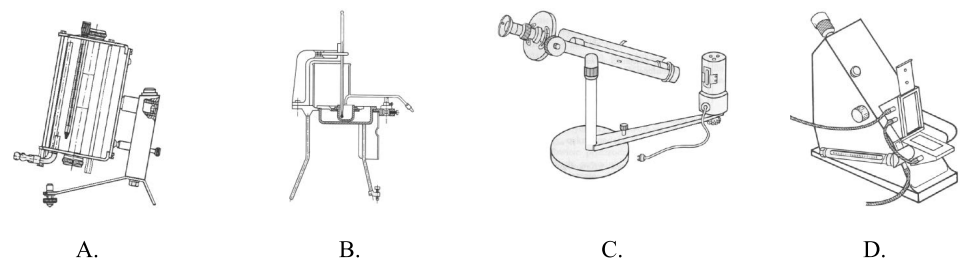
Na którym rysunku przedstawiono przyrząd do pomiaru współczynnika załamania światła?
Przy separacji osadu z roztworu za pomocą wirówki laboratoryjnej istotne jest, aby rotor wirówki
Twardość ogólna badanej wody wynosi 2,5 mval/l. Wartość ta wyrażona w mg CaCO3/l wynosi
| Tabela. Jednostki twardości wody | |||||
| Jednostka twardości | mmol/l | mval/l | mg CaCO3/l | °f stopień francuski | °n stopień niemiecki |
|---|---|---|---|---|---|
| 1 mmol/l | 1 | 2 | 100 | 10 | 5,6 |
| 1 mval/l | 0,5 | 1 | 50 | 5,0 | 2,8 |
| 1 mg CaCO3/l | 0,01 | 0,02 | 1 | 0,1 | 0,056 |
| 1 stopień francuski (°f) | 0,1 | 0,2 | 10 | 1 | 0,56 |
| 1 stopień niemiecki (°n) | 0,178 | 0,357 | 17,8 | 1,78 | 1 |
Ilość flawonoidów, które wykazują działanie antyoksydacyjne, powinna wynosić dziennie 1000 mg. Oblicz, jak wiele gramów czarnej porzeczki należy zjeść, aby zaspokoić potrzebę na antyoksydanty, wiedząc, że 100 g czarnej porzeczki zawiera 640 mg flawonoidów.
Na podstawie danych w tabelach 1-2 zawierających wartości graniczne wskaźników jakości wody i uzyskane wyniki pomiarowe oceń jakość wody w punktach pomiarowych X i Y, określając jej klasę.
Który sprzęt laboratoryjny przedstawiono na ilustracji?

Spektrofotometria w podczerwieni (IR) to technika bazująca na absorpcji promieniowania w zakresie długości fal
Z jaką precyzją należy zważyć próbkę o masie 20 mg, aby błąd względny nie wynosił więcej niż 0,05%?
Ogólna twardość próbki wody stosowanej w technologiach wynosi 16,5°n, a twardość węglanowa osiąga 7,2°n. Jaką wartość ma twardość stała?
W równaniu dotyczącym iloczynu rozpuszczalności siarczanu(VI) baru: Kso = [Ba2+][SO42-], jonowe stężenia Ba2+ oraz SO42- są przedstawione jako
Który rodzaj naczynka konduktometrycznego przedstawiono na rysunku?

Jakie aspekty nie są objęte badaniami organoleptycznymi olejów rafinowanych?
Na etykiecie odczynnika chemicznego zawarte są następujące informacje. Z informacji wynika, że odczynnik ten może być zastosowany do sporządzenia roztworu o stężeniu około 0,1 mol/dm3 z dokładnością do
| NH4SCN amonu tiocyjanian | 0,1 mol/l |
| Stężenie po rozcieńczeniu do 1000 ml w 20°C | 0,1 mol/l ± 0,2 % |