Pytanie 1
Odczynnikiem grupowym kationów IV grupy analitycznej jest
| A. | H2S w roztworze NH3(aq) i NH4Cl. |
| B. | roztwór HCl o stężeniu 2 mol/dm3. |
| C. | (NH4)2CO3 w roztworze NH3(aq) i NH4Cl. |
| D. | H2S w roztworze HCl o stężeniu 0,3 mol/dm3. |
Wynik: 31/40 punktów (77,5%)
Wymagane minimum: 20 punktów (50%)
Odczynnikiem grupowym kationów IV grupy analitycznej jest
| A. | H2S w roztworze NH3(aq) i NH4Cl. |
| B. | roztwór HCl o stężeniu 2 mol/dm3. |
| C. | (NH4)2CO3 w roztworze NH3(aq) i NH4Cl. |
| D. | H2S w roztworze HCl o stężeniu 0,3 mol/dm3. |
Bufor amonowy to system kwasowo-zasadowy złożony z wodnego roztworu
Toksyczność względną zanieczyszczeń opisuje wzór:
Korzystając z danych z tabeli, oblicz toksyczność względną węglowodorów.
| Zanieczyszczenia emitowane do ekosystemu powietrza | NDS [ppm] |
|---|---|
| CO | 40,0 |
| CxHy | 19,3 |
| SO2 | 1,4 |
| NOx | 0,5 |

Wykonano jodometryczne oznaczenie zawartości kwasu askorbinowego dla 4 próbek tabletek witaminy C, uzyskując wyniki:
Na podstawie informacji zawartych w opisie i wyników analizy można stwierdzić, że zawartość witaminy C
| Próbka | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Zawartość kwasu askorbinowego | 198,5 mg | 211 mg | 201 mg | 205 mg |
W procedurze wykrywania cukrów stosowane są następujące. Wymienione związki chemiczne służą do sporządzenia odczynników
| CuSO4·5H2O, NaOH, C2H4O2(COO)2NaK, H2SO4. |
W świadectwie jakości roztworu amoniaku cz. podana jest informacja: zawartość amoniaku 30÷32% m/m Uwzględniając informacje zawarte w tabeli, określ gęstość tego roztworu w temperaturze 20°C.
| Zależność gęstości roztworu amoniaku od stężenia w 20°C | |||||||
|---|---|---|---|---|---|---|---|
| % wagowy | 1 | 6 | 10 | 16 | 20 | 26 | 30 |
| gęstość [g/cm³] | 0,9939 | 0,9730 | 0,9575 | 0,9362 | 0,9229 | 0,9040 | 0,8920 |
Czym jest efekt wspólnego jonu?
Oblicz ilość amoniaku w badanej próbce, jeśli do jej zmiareczkowania wykorzystano 20,0 cm3 roztworu HCl o stężeniu 0,1 mol/dm3.
Roztwór tiocyjanianu amonu NH4SCN jest wykorzystywany jako titrant w oznaczaniu bromków przy użyciu metody miareczkowania?
Konduktometria to technika analityczna, która opiera się na pomiarze
| Zawartość chlorowodoru w próbce można obliczyć wg wzoru: mB = CA · VA⁄1000 · pB⁄pA · MB w którym: mB – masa analizowanej substancji [g] CA – stężenie titranta [mol/dm3] VA – objętość titranta [cm3] pA i pB – współczynniki stechiometryczne reakcji, odpowiednio titranta i substancji oznaczanej MB – masa molowa substancji oznaczanej; 36,46 g/mol Do oznaczenia zużyto średnio 20,0 cm3 titranta, którego stężenie wynosiło 0,1000 mol/dm3. Obliczono masę próbki, która wyniosła 0,07292 g. |
| A. | HCl + NaOH → NaCl + H2O |
| B. | 3HCl + Al(OH)3 → AlCl3 + 3H2O |
| C. | 2HCl + Na2CO3 → 2NaCl + H2O + CO2 |
| D. | 2HCl + Na2B4O7 + 5H2O → 4H3BO3 + 2NaCl |
Liczba wskazująca ilość (w mg) KOH potrzebną do zneutralizowania wolnych kwasów tłuszczowych obecnych w badanym tłuszczu, to liczba
Zawartość kwasu octowego oznaczano alkacymetrycznie, mierząc zmiany przewodnictwa właściwego mieszaniny reakcyjnej w wyniku dodawania roztworu NaOH. Przebieg miareczkowania przedstawiają linie
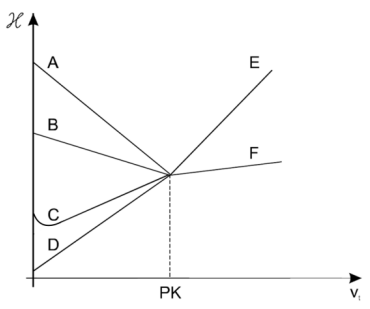
Który rodzaj naczynka konduktometrycznego przedstawiono na rysunku?

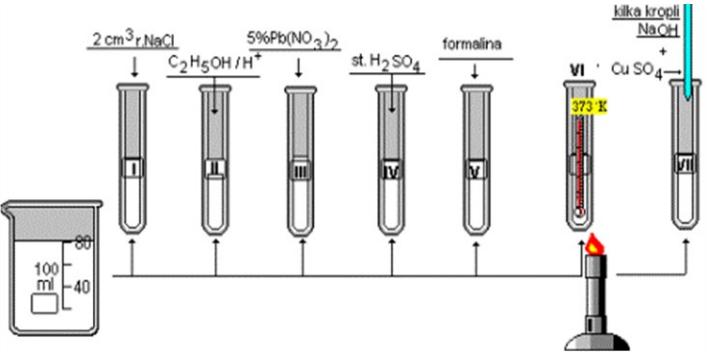
Na rysunku przedstawiono schemat doświadczenia pozwalającego na zbadanie właściwości
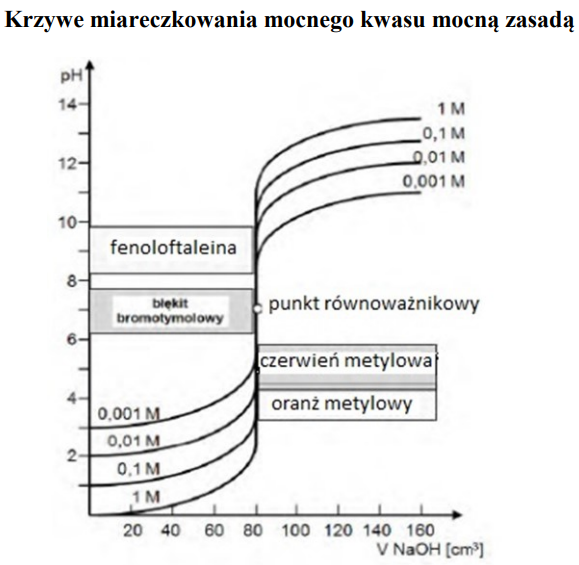
Z analizy wykresu wynika, że do miareczkowania 0,001-molowego roztworu mocnego kwasu za pomocą 0,001-molowego roztworu mocnej zasady nie można zastosować jako wskaźnika
Ile wynosi mnożnik analityczny żelaza oznaczanego wagowo w postaci Fe2O3?
| MFe = 55,845 g/mol | MFe2O3 = 159,687 g/mol |
Do analizy pobrano próbkę o masie 200 mg. Na podstawie informacji zamieszczonych w tabeli określ, w której skali będzie wykonana ta analiza.
| Wielkość próbki | Skala analizy |
|---|---|
| > 0,1 g | makro |
| 0,01 – 0,1 g | semimikro |
| 0,0001 – 0,01 g | mikro |
| < 10-4 g | ultramikro |
Który z reagentów można wykorzystać do wykrywania skrobi?
Związki lotne, które występują w wielu roślinach i mogą być wydobywane, np. poprzez destylację z parą wodną lub dzięki ciągłej ekstrakcji w aparacie Soxhleta, to
Aby wykryć obecność jonów SO42- w wodzie, należy zastosować roztwór
Dostanie się do środowiska pałeczek Salmonella, hodowanych na podłożach mikrobiologicznych, skutkuje
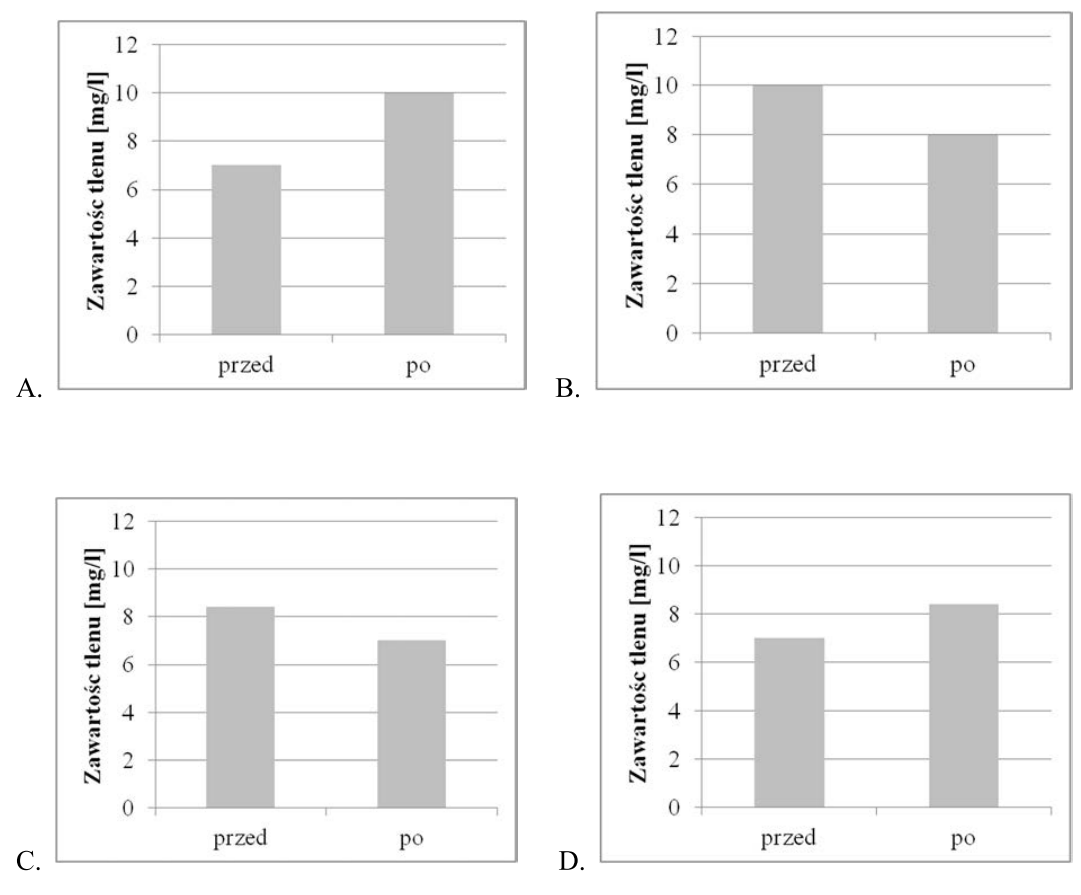
Badaniom poddano wodę z akwarium przed napowietrzaniem i po napowietrzaniu. Wiadomo, że zawartość tlenu w wodzie powinna wzrosnąć o 20%. Który z wykresów obrazuje wyniki tych badań?
Obecność skrobi w bulwie ziemniaka można wykryć, stosując
Na schemacie przedstawiono mechanizm działania wskaźników
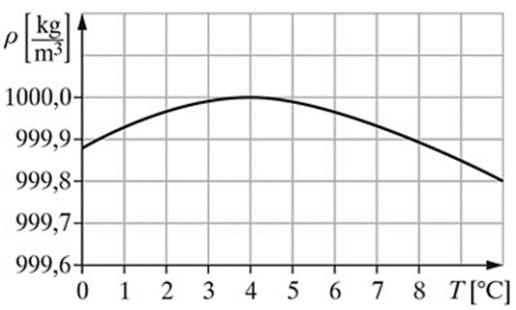
Na podstawie przedstawionego na rysunku wykresu zależności gęstości wody od temperatury, określ w jakiej temperaturze gęstość wody wynosi 1 g/cm3.
Zespół enzymów, obecny zarówno w organizmach roślinnych, jak i zwierzęcych, który katalizuje proces hydrolizy wiązań peptydowych w białkach oraz peptydach, to
Do czego używa się polarymetru?
Na podstawie informacji zamieszczonych w tabeli wskaż wzór związku, który wytrąci się w postaci osadu.
| Badany kation | Odczynnik grupowy | NaOH | Barwienie płomienia |
|---|---|---|---|
| Mg2+ | brak | biały osad | |
| K+ | brak | fiołkowy | |
| Na+ | brak | żółty |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zestaw zawierający palnik gazowy, statyw, łącznik, pierścień, trójkąt ceramiczny oraz tygiel porcelanowy z pokrywką jest stosowany w trakcie oznaczeń
Czym są lipidy złożone?
Badanie organoleptyczne wody przeznaczonej do ludzkiego spożycia obejmuje określenie
Wśród wskaźników stosowanych w analizach kompleksometrycznych znajdują się
Skalę wzorców do oznaczenia zawartości ołowiu przygotowano w cylindrach Nesslera o pojemności 100 cm3. Zawartość ołowiu oznaczona w tabeli jako X wynosi
| Ilość wzorcowego roztworu roboczego ołowiu w cm3 | 0,0 | 0,5 | 1,0 | 2,0 | 3,0 |
| Zawartość ołowiu w mg | 0,0 | 0,005 | X | 0,020 | 0,030 |
W temperaturze 20°C wyznaczono gęstość i współczynnik załamania światła kwasu butanowego. Wyniki zestawiono w tabeli. Refrakcja molowa kwasu butanowego wynosi
| Gęstość | Współczynnik załamania światła |
|---|---|
| 0,960 g/cm³ | 1,398 |
| RM = n2 - 1 n2 + 2 M d |
| RM – refrakcja molowa, cm3/mol n – współczynnik załamania światła d – gęstość, g/cm3 M – masa molowa, 88 g/mol |
Wykonano analizę mikrobiologiczną próbki wody wodociągowej o objętości 100 ml i uzyskano wyniki:
Wymagania mikrobiologiczne, jakim powinna odpowiadać woda wodociągowa wprowadzana | |||
|---|---|---|---|
| Lp. | Parametr | Wartość parametryczna | |
| liczba mikroorganizmów [jtk lub NPL] | objętość próbki [ml] | ||
| 1. | Escherichia coli | 0 | 250 |
| 2. | Enterokoki | 0 | 250 |
| 3. | Pałeczka ropy błękitnej (Pseudomonas aeruginosa) | 0 | 250 |
| 4. | Ogólna liczba mikroorganizmów w 36±2°C | 20 | 1 |
| 5. | Ogólna liczba mikroorganizmów w 22±2°C | 100 | 1 |
| Escherichia coli | nieobecne |
| Enterokoki | nieobecne |
| Pałeczki ropy błękitnej | nieobecne |
| Ogólna liczba mikroorganizmów w 37°C | 1200 |
| Ogólna liczba mikroorganizmów w 22°C | 11000 |
Jaki wskaźnik jest używany do oceny kontaktu między wodami naturalnymi a fekaliami?
Roztwór, który powstaje z mieszaniny słabego kwasu oraz jego soli z mocną zasadą lub słabej zasady i jej soli z mocnym kwasem, to
W celu wykonania analizy mieszaniny kationów grup I - V należy wybrać sprzęt oznaczony w tabeli numerami:
| Palnik gazowy | Kolba stożkowa | Drut platynowy na pręcie szklanym | Biureta | Płytka ceramiczna do eksperymentów kroplowych | Kolba miarowa |
| 1 | 2 | 3 | 4 | 5 | 6 |