Pytanie 1
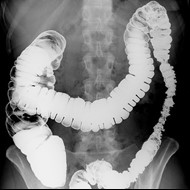
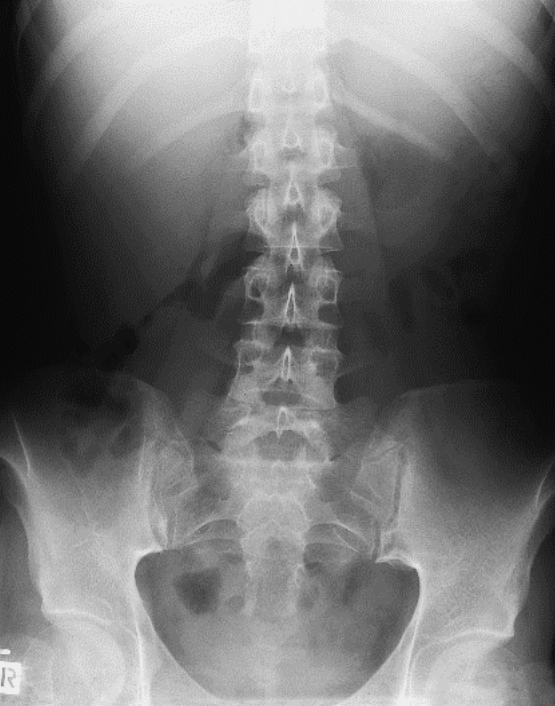
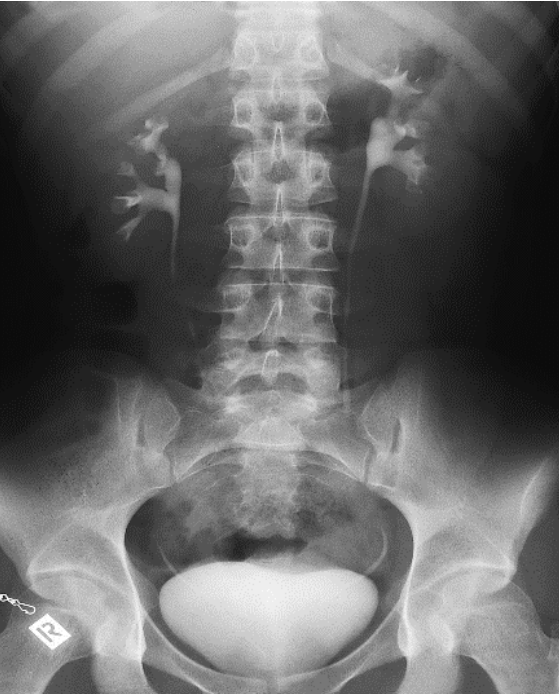
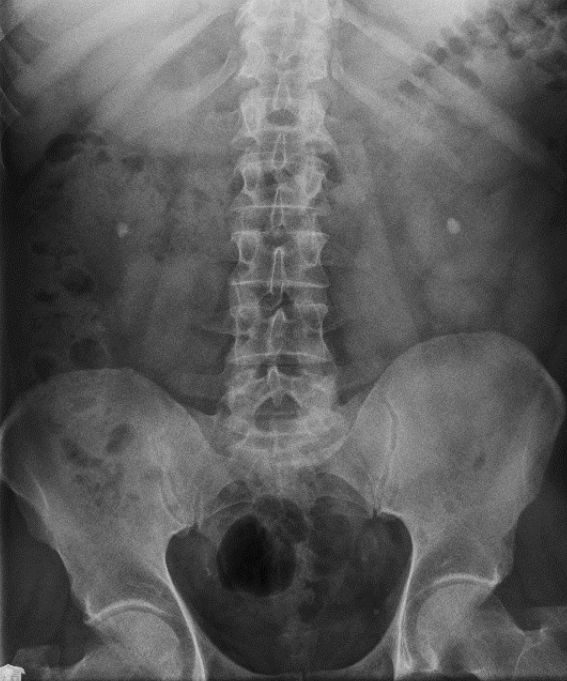
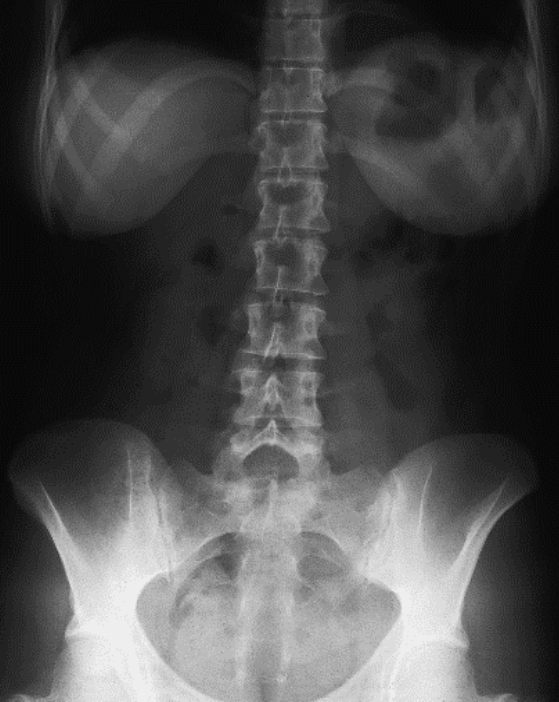
Przedstawiony obraz radiologiczny został zarejestrowany podczas badania jelita
Wynik: 29/40 punktów (72,5%)
Wymagane minimum: 20 punktów (50%)
Przedstawiony obraz radiologiczny został zarejestrowany podczas badania jelita

Gruboziarnista folia wzmacniająca wpływa na zwiększenie na obrazie rentgenowskim nieostrości
W scyntygrafii wykorzystywane są głównie radioizotopy emitujące promieniowanie
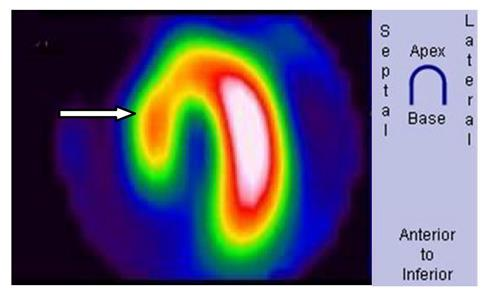
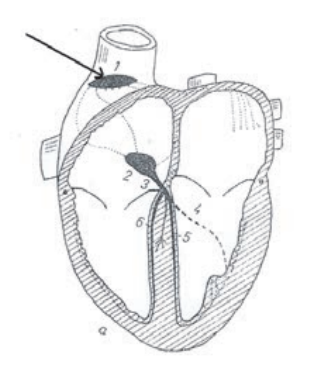
Na obrazie scyntygrafii perfuzyjnej serca strzałką wskazano ścianę
W badaniu EKG odprowadzenie I rejestruje różnicę potencjałów między
Cholangiografia to badanie radiologiczne
Przemiana promieniotwórcza radu w ren opisana wzorem \( {}_{88}^{226}\text{Ra} \to {}_{86}^{222}\text{Rn} + {}_{2}^{4}\text{He} \) jest rozpadem
W ultrasonografii występuje zależność:
W badaniu PET CT wykorzystuje się radioizotopy emitujące promieniowanie
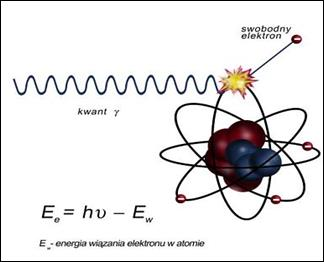
Na ilustracji przedstawiono zjawisko
Lordoza to fizjologiczna krzywizna kręgosłupa występująca
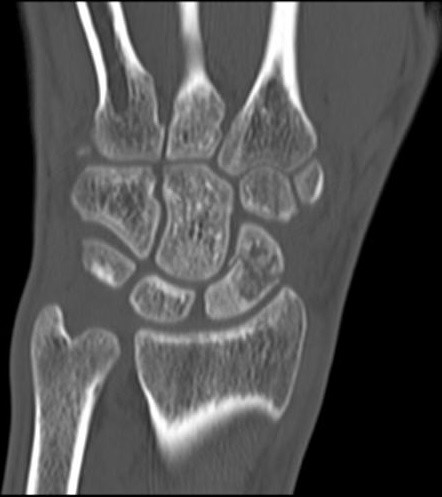
Na obrazie TK nadgarstka uwidocznione jest złamanie kości
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
Na jakim etapie procesu karcynogenezy dochodzi do inwazji miejscowej nowotworu i tworzenia przerzutów odległych?
Promieniowanie jonizujące pośrednio to
Rozpraszanie promieniowania X, w wyniku którego następuje zwiększenie długości fali promieniowania, to zjawisko
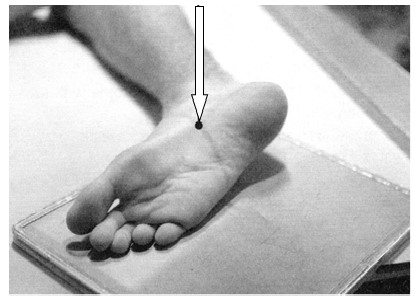
Na ilustracji przedstawiono ułożenie pacjenta do wykonania zdjęcia rentgenowskiego
Jaka jest odległość pomiędzy źródłem promieniowania a powierzchnią ciała pacjenta w technice izocentrycznej radioterapii?
W jaki sposób należy ustawić promień centralny w stosunku do ramienia i przedramienia, by wykonać zdjęcie rentgenograficzne stawu łokciowego u pacjenta z przykurczem?
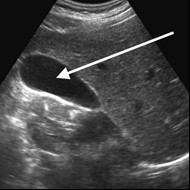
Na obrazie ultrasonograficznym jamy brzusznej strzałką wskazano
Który detektor w radiografii wymaga laserowego czytnika obrazu?
Jaki sposób frakcjonowania dawki jest stosowany w radioterapii konwencjonalnej?
Wskazaniem do wykonania badania spirometrycznego jest
Strzałką na schemacie oznaczono
W radiografii mianem SID określa się
W pracowni ultrasonograficznej technik elektroradiolog nie korzysta z przepisów dotyczących
W radiologii analogowej lampy rentgenowskiej z tubusem używa się do wykonania zdjęcia
Jakie struktury anatomiczne uwidoczniono na obrazie USG?
Które odprowadzenie w badaniu EKG rejestruje różnice potencjałów pomiędzy lewym a prawym przedramieniem?
Ile razy i jak zmieni się wartość natężenia promieniowania X przy zwiększeniu odległości OF ze 100 cm do 200 cm?
Kiedy w procesie terapii wykonuje się badanie CBCT (cone beam computed tomography)?
W badaniu audiometrycznym do oceny przewodnictwa kostnego wybranego ucha słuchawkę kostną należy przyłożyć do
Elementem pomocniczym w radioterapii, zapewniającym powtarzalność ułożenia w pozycji terapeutycznej, a także unieruchomienie pacjenta, jest
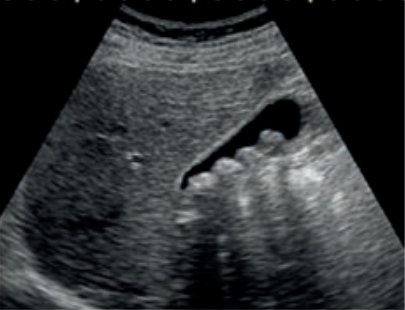
Na którym radiogramie uwidoczniona jest kamica nerkowa?
Celem radioterapii paliatywnej nie jest
Pielografia to badanie układu
Które znaczniki są wykorzystywane w scyntygrafii tarczycy?
Folia wzmacniająca umieszczona w kasecie rentgenowskiej emituje pod wpływem promieniowania X światło
W badaniu EEG w systemie „10-20” elektrody w okolicy skroniowej oznaczone są literą
Standardowo do wykonania których zdjęć należy zastosować kratkę przeciwrozproszeniową?