Pytanie 1
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
Wynik: 40/40 punktów (100,0%)
Wymagane minimum: 20 punktów (50%)
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
Jakim kolorem oznacza się instalację gazową w laboratorium analitycznym?
Rozpuszczalność siarczanu(VI) potasu przy temperaturze 30oC wynosi 13 g na 100 g wody. Jaką masę tego związku należy dodać do wody, aby uzyskać 500 g roztworu nasyconego?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na rysunku przedstawiono zestaw do oczyszczania jodu w procesie
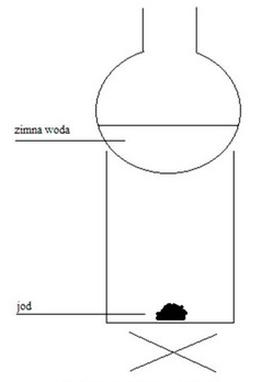
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie proporcje objętościowe powinny być zastosowane do zmieszania roztworu etanolu o stężeniu 30% (V/V) z roztworem o stężeniu 70% (V/V), aby uzyskać roztwór o stężeniu 50% (V/V)?
Przeprowadzono reakcję 13 g cynku z kwasem solnym zgodnie z równaniem: Zn + 2 HCl → ZnCl2 + H2↑. Otrzymano 1,12 dm3 wodoru (w warunkach normalnych). Masy molowe to: MZn = 65 g/mol, MH = 1g/mol, MCl = 35,5g/mol. Jaka jest wydajność tego procesu?
Aby oczyścić zwęglone osady w probówce, należy zastosować
Roztwory o ściśle określonym stężeniu, używane w analizach miareczkowych, nazywamy
Aby oddzielić połączenia szlifów, należy w miejscu ich styku wprowadzić
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Odczynnik, który nie został wykorzystany, należy zutylizować zgodnie z informacjami zawartymi na etykiecie
Najskuteczniejszą techniką separacji ketonu oraz kwasu karboksylowego obecnych w roztworze benzenowym jest
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Mianowanie roztworu o stężeniu przybliżonym można wykonać poprzez
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Intensywna reakcja z FeCl3 jest wykorzystywana do identyfikacji
Podczas pipetowania menisk górny określa się dla roztworów
Który z etapów przygotowania próbek do analizy opisano w ramce?
| Proces polegający na usuwaniu wody z zamrożonego materiału na drodze sublimacji lodu, tzn. bezpośredniego jego przejścia w stan pary z pominięciem stanu ciekłego. |
Do 200 g roztworu NaOH (M = 40 g/mol) o stężeniu 10 % dodano wodę destylowaną w kolbie miarowej o pojemności 500 cm3 do znaku. Jakie jest stężenie molowe powstałego roztworu?
Wskaż sprzęt, którego należy użyć, aby przygotować 100 cm3 roztworu NaOH o stężeniu 0,1 mol/dm3.
| 1 | 2 | 3 | 4 | 5 |
| naczynko wagowe | waga analityczna | kolba stożkowa | kolba miarowa pojemności 50 cm3 | kolba miarowa pojemności 100 cm3 |
Wykonano ocenę jakości dostarczonej partii wodorotlenku sodu.
Zgodne ze specyfikacją towaru są
| Parametr oznaczany | Jednostka | Wartość parametru | |
|---|---|---|---|
| Według specyfikacji | Zbadana analitycznie | ||
| Zawartość wodorotlenku sodu | % | >=98 | 98,3 |
| Zawartość węglanu sodu | % | <=0,4 | 0,39 |
| Zawartość chlorku sodu | % | <=0,015 | 0,015 |
Na podstawie zamieszczonych w tabeli opisów metod rozdzielania mieszanin, dobierz odpowiadające im nazwy.
| Tabela. Metody rozdzielania mieszanin | |
|---|---|
| Lp. | Opis metody |
| I. | Zlewanie cieczy znad osadu. |
| II. | Przeprowadzenie ciekłego rozpuszczalnika w stan pary. |
| III. | Wyodrębnianie z mieszaniny ciał stałych lub cieczy składnika przy pomocy rozpuszczalnika tak dobranego, aby rozpuszczał żądany związek chemiczny. |
| IV. | Powolne opadanie cząstek substancji stałej w cieczy pod wpływem własnego ciężaru. |
Na etykiecie odważki analitycznej znajduje się napis: Z odważki tej można przygotować
Odważka analityczna azotan(V) srebra(I) AgNO3 0,1 mol/dm3 |
Do metalowego sprzętu laboratoryjnego używanego w praktykach analitycznych zalicza się
Wskaź sprzęt laboratoryjny, który znajduje się w zestawie do filtracji pod obniżonym ciśnieniem?
W przypadku kontaktu ze stężonym roztworem zasady, co należy zrobić jak najszybciej?
Symbol "In" znajduje się na
Różnica pomiędzy średnim wynikiem pomiaru a wartością rzeczywistą stanowi błąd
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przedstawiony na rysunku zestaw służy do destylacji
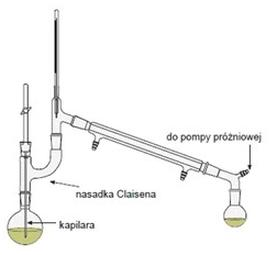
Aby przeprowadzić syntezę substancji organicznej w temperaturze 150°C, należy zastosować łaźnię
Jednym z sposobów oddzielania jednorodnych mieszanin jest
W trakcie korzystania z odczynnika opisanego na etykiecie, należy szczególnie zwrócić uwagę na zagrożenia związane
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.