Pytanie 1
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
Wynik: 31/40 punktów (77,5%)
Wymagane minimum: 20 punktów (50%)
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Urządzeniem pomiarowym nie jest
Wskaż sprzęt, którego należy użyć, aby przygotować 100 cm3 roztworu NaOH o stężeniu 0,1 mol/dm3.
| 1 | 2 | 3 | 4 | 5 |
| naczynko wagowe | waga analityczna | kolba stożkowa | kolba miarowa pojemności 50 cm3 | kolba miarowa pojemności 100 cm3 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
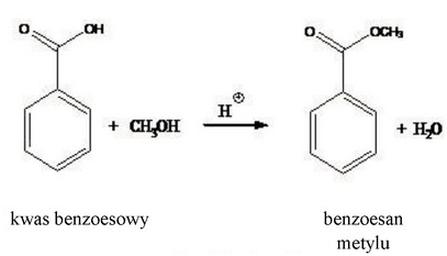
Do reakcji estryfikacji użyto 150 g kwasu benzoesowego (M = 122,12 g/mol), w wyniku której otrzymano czysty preparat benzoesanu metylu (M = 136,2 g/mol). Ile gramów benzoesanu metylu otrzymano, jeżeli reakcja przebiegała z wydajnością 92%?
Brak odpowiedzi na to pytanie.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Symbol "In" znajduje się na
W celu sprawdzenia stężenia kwasu siarkowego(VI) odważono 1 g badanego kwasu i przeprowadzono analizę miareczkową, w której zużyto 20,4 \( \text{cm}^3 \) roztworu NaOH.
Stężenie procentowe badanego kwasu, obliczone na podstawie wzoru wynosi
$$ C_p = \frac{0,02452 \cdot V_{NaOH}}{mp} \cdot 100\% $$gdzie:
\( C_p \) – stężenie procentowe badanego kwasu; \( \% \)
\( 0,02452 \) – współczynnik przeliczeniowy; \( \text{g/cm}^3 \)
\( V_{NaOH} \) – objętość roztworu NaOH, zużyta w miareczkowaniu; \( \text{cm}^3 \)
\( mp \) – odważka badanego kwasu; g
Jakie jest pH 0,001-molowego roztworu NaOH?
Butle gazowe (czasy butli) napełnione wodorem są oznaczone kolorem
Jaką metodą nie można rozdzielać mieszanin?
Jaką próbkę stanowi woreczek gleby pobranej zgodnie z instrukcją?
| Instrukcja pobierania próbek glebowych | |
| Próbki pierwotne pobiera się laską glebową z wierzchniej warstwy gleby 0-20 cm, kolejno wykonując czynności: – w miejscu pobierania próbki pierwotnej (pojedynczej), rolę świeżo zaoraną przydeptać, – pionowo ustawić laskę do powierzchni gleby, – wcisnąć laskę do oporu (na wysokość poprzeczki ograniczającej), – wykonać pełny obrót i wyjąć laskę, – zawartość wgłębienia (zasobnika) przenieść do pojemnika skrobaczki. Po pobraniu próbek pojedynczych, całość wymieszać i napełnić kartonik lub woreczek. | |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Ile gramów cukru trzeba dodać do 200 gramów wody o temperaturze 20°C, aby uzyskać roztwór nasycony?
Które równanie przedstawia reakcję otrzymywania mydła?
| CH3COOH + NaOH →CH3COONa + H2O | 2 CH3COOH + Na2O →2 CH3COONa + H2O | 2 C2H5COOH + 2 Na →2 C2H5COONa + H2↑ | C17H35COOH + NaOH →C17H35COONa + H2O |
Jaką masę chlorku sodu można znaleźć w 150 g roztworu soli o stężeniu 5% (m/m)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przygotować mianowany roztwór KMnO4, należy odważyć wysuszone Na2C2O4 o masie zbliżonej do 250 mg, z dokładnością wynoszącą 1 mg. Jaką masę powinna mieć prawidłowo przygotowana odważka?
W przypadku rozlania żrącego odczynnika chemicznego na skórę pierwszym poprawnym działaniem jest:
Po rozpuszczeniu substancji w kolbie miarowej, należy odczekać przed dopełnieniem jej wodą "do kreski" miarowej. Taki sposób postępowania jest uzasadniony
Ile gramów 80% kwasu mrówkowego trzeba zważyć, aby uzyskać 200 g 20% roztworu tego kwasu?
W przypadku odczynnika, w którym nawet najczulsze techniki analizy chemicznej nie są w stanie wykryć zanieczyszczeń, a jego badanie wymaga zastosowania metod opartych na zjawiskach fizycznych, zalicza się on do kategorii czystości
Proces wydobywania składnika z cieczy lub ciała stałego w mieszance wieloskładnikowej poprzez jego rozpuszczenie w odpowiednim rozpuszczalniku to
Pobieranie próbek wody z zbiornika wodnego, który zasila system wodociągowy, powinno odbywać się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Skalę wzorców do oznaczenia barwy przygotowano w cylindrach Nesslera o pojemności 100 cm3. Barwa oznaczona w tabeli jako X wynosi
| Skala wzorców do barwy | ||||
|---|---|---|---|---|
| Ilość wzorcowego roztworu podstawowego cm3 (c=500 mg Pt/dm3) | 0 | 1,0 | 2,0 | 3,0 |
| Barwa w stopniach mg Pt/dm3 | 0 | 5 | X | 15 |
Do narzędzi pomiarowych zalicza się
Aby przygotować miano kwasu solnego, konieczne jest odważenie węglanu sodu o masie wynoszącej około 400 mg. Jaką precyzję powinna mieć waga używana do odważenia węglanu sodu?
Jaką substancję należy koniecznie oddać do utylizacji?
Woda, która została poddana dwukrotnej destylacji, to woda
Metoda oczyszczania substancji oparta na różnicach w rozpuszczalności poszczególnych składników w określonym rozpuszczalniku to
Który z poniższych czynników nie mógł przyczynić się do błędnego określenia całkowitej liczby drobnoustrojów w surowym mleku?
Jakie procesy towarzyszy efekt egzotermiczny?
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Po przeprowadzeniu krystalizacji z 120 g kwasu szczawiowego uzyskano 105 g produktu o wysokiej czystości. Jaki był poziom zanieczyszczeń w kwasie szczawiowym?