Pytanie 1
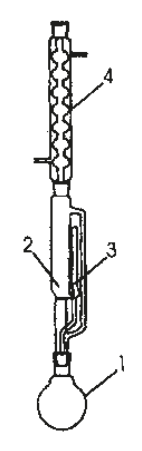
Aparat przedstawiony na rysunku służy do
Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Aparat przedstawiony na rysunku służy do

Zbiór próbek pierwotnych tworzy próbkę
Jakie urządzenie wykorzystuje się do pomiaru lepkości cieczy?
Gdzie należy przechowywać cyjanek potasu KCN?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Substancje kancerogenne to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do wykrywania pierwiastków w niskich stężeniach w badaniach spektrograficznych należy używać reagentów
Jaką objętość roztworu NaOH o stężeniu 1 mol/dm3 należy użyć, aby przygotować 50 cm3 roztworu NaOH o stężeniu 0,4 mol/dm3?
Które równanie przedstawia reakcję otrzymywania mydła?
| CH3COOH + NaOH →CH3COONa + H2O | 2 CH3COOH + Na2O →2 CH3COONa + H2O | 2 C2H5COOH + 2 Na →2 C2H5COONa + H2↑ | C17H35COOH + NaOH →C17H35COONa + H2O |
W trakcie określania miana roztworu NaOH, do zmiareczkowania 25,0 cm3 tego roztworu, użyto 30,0 cm3 roztworu HCl o stężeniu 0,1000 mol/dm3. Jakie miało miano zasady?
Jaką objętość powinna mieć kolba miarowa, aby przygotować mianowany roztwór NaOH o stężeniu 0,050 M z analitycznej odważki, która zawiera 0,1 mola NaOH?
W wypadku oblania skóry kwasem mrówkowym należy
| Wyciąg z karty charakterystyki Skład: kwas mrówkowy 80%, woda 11-20% Pierwsza pomoc. Po narażeniu przez drogi oddechowe. Natychmiast wezwać lekarza. Po kontakcie ze skórą. Zanieczyszczoną skórę natychmiast przemyć dużą ilością wody. |
Z analizy wykresu wynika, że substancją o najniższej rozpuszczalności w wodzie w temperaturze 100°C jest
W celu rozdrabniania niewielkich ilości bardzo twardego materiału wykorzystuje się moździerze
W laboratorium chemicznym przewody instalacji rurowych są oznaczane różnymi kolorami, zgodnie z obowiązującymi normami. Polska Norma PN-70 N-01270/30 określa kolor dla wody jako
Jakie urządzenie służy do pomiaru temperatury topnienia substancji chemicznych?
W celu usunięcia drobnych zawiesin z roztworu przed analizą spektrofotometryczną stosuje się:
Jak definiuje się próbkę wzorcową?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Substancje pomocnicze wykorzystywane do realizacji podstawowych analiz jakościowych i ilościowych, które nie wymagają wysokiej czystości, są oznaczane na opakowaniach symbolem
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
Który z wymienionych roztworów NaOH, o określonych stężeniach, nie jest roztworem mianowanym?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przedstawiony na rysunku sprzęt służy do

Którą substancję można bezpośrednio wyrzucić do odpadów komunalnych?
Odczynnik, który nie został wykorzystany, należy zutylizować zgodnie z informacjami zawartymi na etykiecie
Przy przygotowywaniu 100 cm3 roztworu o określonym stężeniu procentowym (m/V) konieczne jest odważenie wyliczonej ilości substancji, a następnie przeniesienie jej do
Roztwory, które wykorzystuje się do kalibracji pehametrów, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jak nazywa się naczynie o płaskim dnie, które wykorzystuje się do pozyskiwania substancji stałej poprzez stopniowe odparowanie rozpuszczalnika z roztworu?
Masa molowa kwasu azotowego(V) wynosi 63,0 g/mol. Jakie jest stężenie molowe 20% roztworu tego kwasu o gęstości 1,1 g/cm3?
Jaką objętość zasady sodowej o stężeniu 1,0 mol/dm3 należy dodać do 56,8 g kwasu stearynowego, aby otrzymać mydło sodowe (stearynian sodu)?
| C17H35COOH + NaOH → C17H35COONa + H2O |
| (MC17H35COOH = 284 g/mol, MC17H35COONa = 306 g/mol, MNaOH = 40 g/mol, MH2O= 18 g/mol) |
Jakie substancje są potrzebne do uzyskania nierozpuszczalnego wodorotlenku cynku?
Jakie jest znaczenie skrótu: cz. na etykiecie reagentu chemicznego?
Próbkę uzyskaną z próbki ogólnej poprzez jej zmniejszenie nazywa się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Intensywna reakcja z FeCl3 jest wykorzystywana do identyfikacji