Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 37/40 punktów (92,5%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
Na diagramie przedstawiającym proces pobierania prób środowiskowych do analizy literą Y oznaczono próbkę
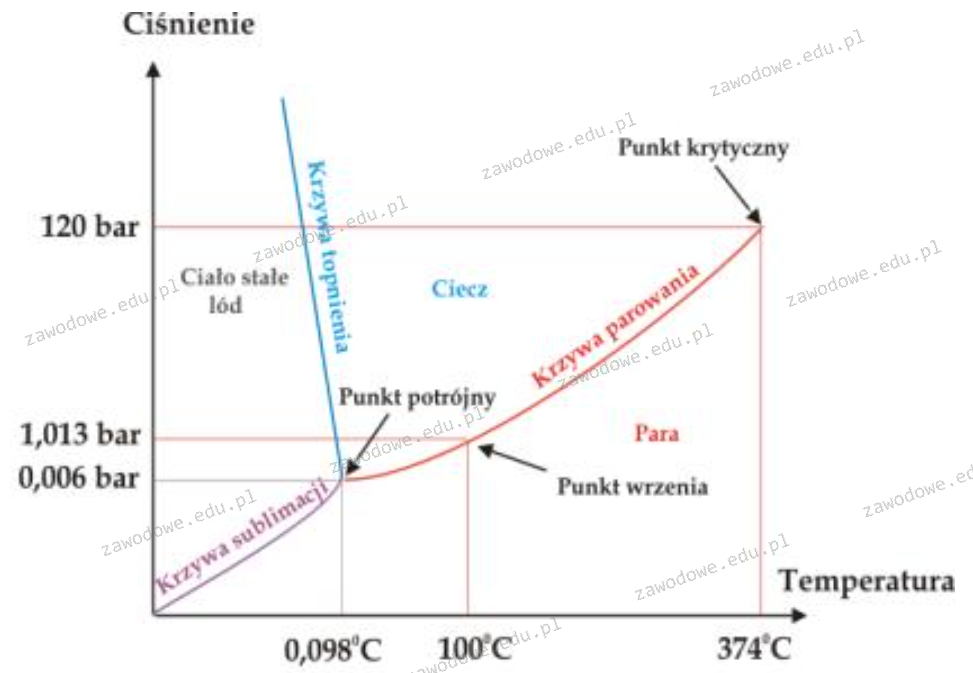
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Jaką substancję należy koniecznie oddać do utylizacji?
Który sposób przechowywania próbek żywności jest niezgodny z Rozporządzeniem Ministra Zdrowia?
| Fragment Rozporządzenia Ministra Zdrowia w sprawie pobierania i przechowywania próbek żywności przez zakłady żywienia zbiorowego typu zamkniętego |
| (...) Zakład przechowuje próbki, przez co najmniej 3 dni, licząc od chwili, kiedy cała partia została spożyta w miejscu wyłącznym właściwym do tego celu oraz w warunkach zapewniających utrzymanie temperatury +4°C lub niższej, w zależności od przechowywanego produktu. Miejsce przechowywania próbek musi być tak zabezpieczone, aby dostęp do niego posiadał tylko kierujący zakładem lub osoba przez niego upoważniona. |
Etykieta roztworu kwasu azotowego(V) o koncentracji 6 mol/dm3 powinna zawierać nazwę substancji oraz
Skuteczny środek do osuszania
Substancje pomocnicze wykorzystywane do realizacji podstawowych analiz jakościowych i ilościowych, które nie wymagają wysokiej czystości, są oznaczane na opakowaniach symbolem
Które równanie przedstawia reakcję otrzymywania mydła?
| CH3COOH + NaOH →CH3COONa + H2O | 2 CH3COOH + Na2O →2 CH3COONa + H2O | 2 C2H5COOH + 2 Na →2 C2H5COONa + H2↑ | C17H35COOH + NaOH →C17H35COONa + H2O |
Odpady z rozpuszczalników organicznych, takich jak benzen czy aceton, zawierające co najmniej 80% danego rozpuszczalnika, należy
W chemicznym laboratorium apteczka pierwszej pomocy powinna zawierać
Różnica pomiędzy średnim wynikiem pomiaru a wartością rzeczywistą stanowi błąd
Wskaż zbiór substancji, które po rozpuszczeniu w wodzie stają się elektrolitami?
W urządzeniu Soxhleta wykonuje się
Zjawisko fizyczne, które polega na rozkładaniu struktury krystalicznej substancji stałej oraz przenikaniu jej cząsteczek lub jonów do cieczy, nosi nazwę
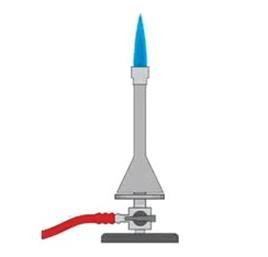
Na rysunku przedstawiono palnik
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Technika oddzielania płynnych mieszanin, w której wykorzystuje się różnice w prędkości migracji składników przez odpowiednią bibułę, nazywa się
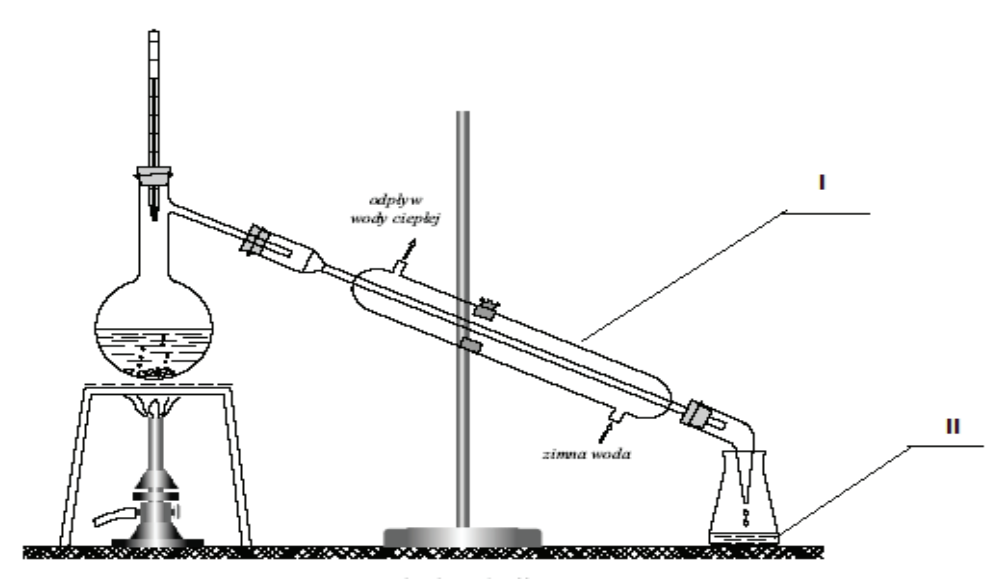
Na rysunku numerami rzymskimi oznaczono
W probówce połączono roztwory CuSO4 oraz NaOH. Powstał niebieski osad, który po podgrzaniu zmienił kolor na czarny. Czarnym osadem jest
Jakie jest przeznaczenie pieca muflowego?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Oddzielanie płynnej mieszaniny wieloskładnikowej poprzez odparowanie, a następnie skraplanie jej komponentów, to proces
Na skutek krystalizacji 18 g kwasu benzoesowego uzyskano 8 g czystego produktu. Jaką wydajność miała ta krystalizacja?
Z kolby miarowej o pojemności 1 dm3, zawierającej roztwór HCl o stężeniu 0,1 mol/dm3, pobrano pipetą 2,5 cm3, a następnie przeniesiono do kolby miarowej o pojemności 20 cm3 i rozcieńczono wodą "do kreski" miarowej. Jakie stężenie ma otrzymany roztwór?
Jakim przyrządem nie jest możliwe określenie gęstości cieczy?
Wskaź zestaw reagentów oraz przyrządów wymaganych do przygotowania 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3?
Transformacja zolu w żel to zjawisko określane jako
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zbiór próbek pierwotnych tworzy próbkę
Przeprowadzono reakcję 13 g cynku z kwasem solnym zgodnie z równaniem: Zn + 2 HCl → ZnCl2 + H2↑. Otrzymano 1,12 dm3 wodoru (w warunkach normalnych). Masy molowe to: MZn = 65 g/mol, MH = 1g/mol, MCl = 35,5g/mol. Jaka jest wydajność tego procesu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W laboratoriach roztwór potasu dichromianu(VI) w stężonym kwasie siarkowym(VI) wykorzystuje się do
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wykonano ocenę jakości dostarczonej partii wodorotlenku sodu.
Zgodne ze specyfikacją towaru są
| Parametr oznaczany | Jednostka | Wartość parametru | |
|---|---|---|---|
| Według specyfikacji | Zbadana analitycznie | ||
| Zawartość wodorotlenku sodu | % | >=98 | 98,3 |
| Zawartość węglanu sodu | % | <=0,4 | 0,39 |
| Zawartość chlorku sodu | % | <=0,015 | 0,015 |
Wskaż jaka zawartość chlorków w próbce wody pozwala na wykorzystanie tej wody do produkcji betonu zgodnie z normą PN-EN 1008.
| Wymagania dotyczące zawartości chlorków w wodzie do produkcji betonu według normy PN-EN 1008 | |
| substancja | dopuszczalna wartość w mg/dm3 |
| chlorki | 1000 |
Resztki szkła, osadników czy inne odpady stałe powstałe w laboratorium analitycznym powinny być umieszczone
W trakcie destylacji cieczy wykorzystuje się tzw. kamienie wrzenne, ponieważ