Pytanie 1
Który z nowotworów jest hormonozależny?
Wynik: 38/40 punktów (95,0%)
Wymagane minimum: 20 punktów (50%)
Który z nowotworów jest hormonozależny?
Którą strukturę anatomiczną i w jakiej projekcji uwidoczniono na radiogramie?
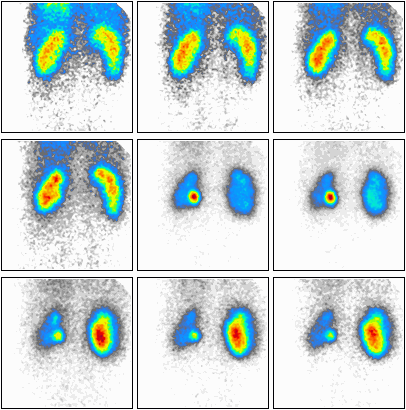
Podczas którego badania zostały zarejestrowane przedstawione obrazy?
Przyczyną zaniku kostnego jest
Która struktura może być oknem akustycznym w badaniu ultrasonograficznym?
Hiperfrakcjonowanie dawki w teleradioterapii polega na napromienianiu 2 do 3 razy dziennie dawką frakcyjną
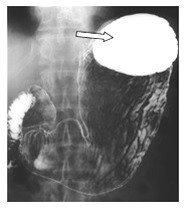
Który element żołądka zaznaczono strzałką na zdjęciu rentgenowskim?
Emisja fali elektromagnetycznej występuje w procesie rozpadu promieniotwórczego
Badanie gęstości mineralnej kości metodą DXA należy wykonać
Na ilustracji przedstawiono przygotowanie pacjenta do badania
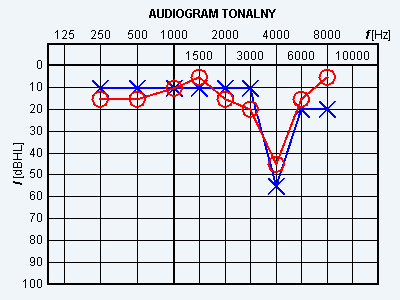
Wynik badania słuchu metodą audiometrii tonalnej wskazuje na
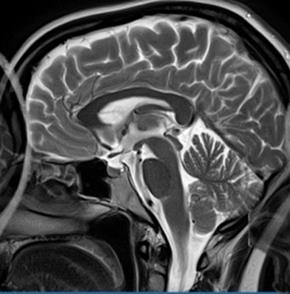
Wskaż przyczynę powstania artefaktu widocznego na obrazie MR.
Jak oznacza się w systemie międzynarodowym czwarty górny ząb mleczny po stronie prawej?
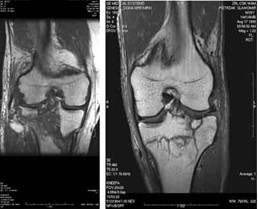
Którą metodą i w której płaszczyźnie zostało wykonane badanie stawu kolanowego zobrazowane na zdjęciach?
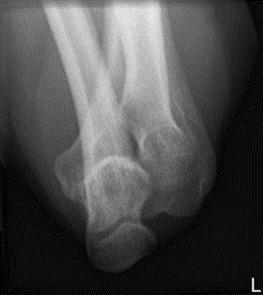
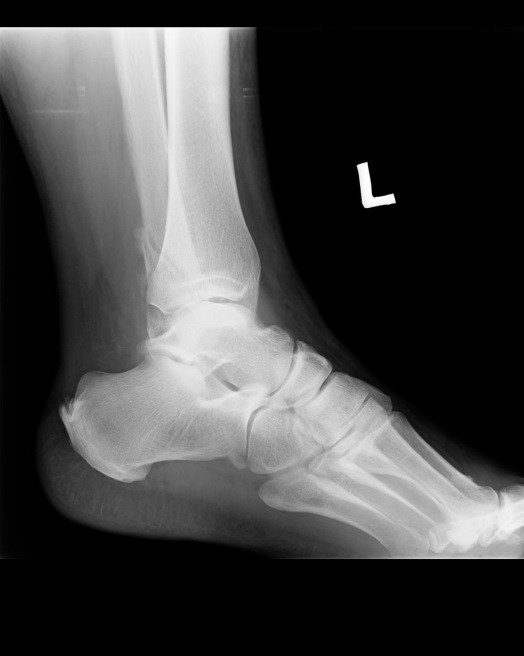
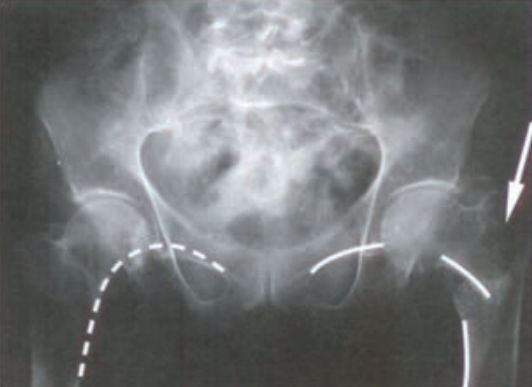
Na obrazie radiologicznym uwidoczniono złamanie kości
Podczas wykonywania zdjęć wewnątrzustnych zębów górnych linia Campera powinna przebiegać w stosunku do płaszczyzny podłogi
Do zdjęcia rentgenowskiego żeber w projekcji skośnej tylnej pacjenta należy ustawić
Cholangiografia to badanie radiologiczne
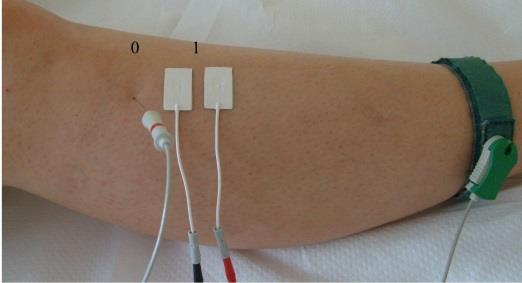
Jakie symbole mają odprowadzenia kończynowe dwubiegunowe w badaniu EKG?
Na elektrokardiogramie uwidoczniono
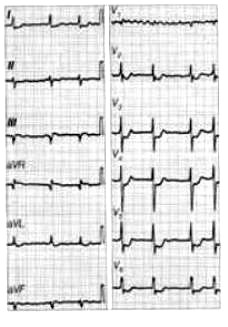
Które odprowadzenie w badaniu EKG rejestruje różnice potencjałów pomiędzy lewym a prawym przedramieniem?
Wskaż osłonę radiologiczną, która jest stosowana w pracowniach radiodiagnostyki stomatologicznej.




Na jakim etapie procesu karcynogenezy dochodzi do inwazji miejscowej nowotworu i tworzenia przerzutów odległych?
Zdjęcie zatok przynosowych wykonuje się w pozycji
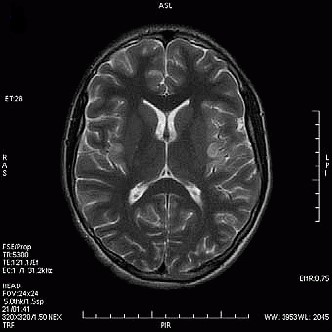
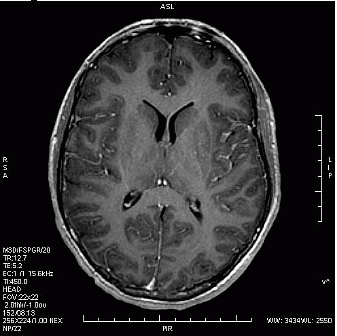
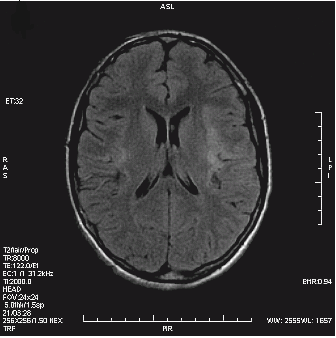
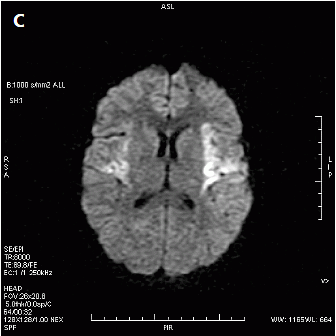
Który obraz MR mózgu został wykonany w sekwencji DWI?
„Ognisko zimne” w obrazie scyntygraficznym określa się jako
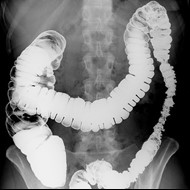
Przedstawiony obraz radiologiczny został zarejestrowany podczas badania jelita
W ułożeniu do rentgenografii AP stawu kolanowego promień główny pada
Podczas wykonywania zdjęcia rentgenowskiego klatki piersiowej w celu ochrony radiologicznej pacjenta należy zastosować
Osłony na gonady dla osób dorosłych powinny posiadać równoważnik osłabienia promieniowania nie mniejszy niż
Radiogram przedstawia
Zadaniem technika elektroradiologa w pracowni naczyniowej jest
W pozytonowej tomografii emisyjnej PET zostaje zarejestrowane promieniowanie powstające podczas
W jakiej pozycji układa się pacjenta do standardowego badania MR kręgosłupa szyjnego?
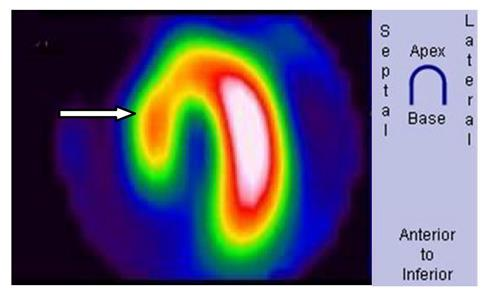
Na obrazie scyntygrafii perfuzyjnej serca strzałką wskazano ścianę
Skrótem HRCT (High Resolution Computed Tomography) określa się tomografię komputerową
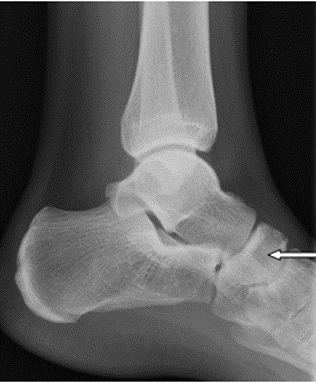
Na zamieszczonym radiogramie strzałką oznaczono kość
Znak umieszczony w pracowni rezonansu magnetycznego zakazuje wstępu osobom

Do środków kontrastujących negatywnych należą
Fistulografia to badanie kontrastowe