Pytanie 1
Rozpraszanie promieniowania świetlnego przez cząstki koloidalne, które mają wymiary mniejsze od długości fali światła, to zjawisko
Wynik: 28/40 punktów (70,0%)
Wymagane minimum: 20 punktów (50%)
Rozpraszanie promieniowania świetlnego przez cząstki koloidalne, które mają wymiary mniejsze od długości fali światła, to zjawisko
Jakie urządzenie wykorzystuje się do pomiaru stężenia dwutlenku węgla, tlenku węgla oraz tlenu w atmosferze i w gazach spalinowych?
Na zmiareczkowanie 10 cm3 roztworu KOH zużyto 10 cm3 0,1000-molowego roztworu H2SO4. Oblicz ilość KOH w badanej próbce w g/100 cm3.
| MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol, MS = 32 g/mol |
W tabeli przedstawiono skalę wzorców do oznaczania barwy wody.
Wyznacz barwę badanej próbki wody, korzystając ze wzoru:
| Numer wzorca | 1. | 2. | 3. | 4. | 5. |
| Odmierzona ilość roztworu wzorcowego [cm3] | 0 | 1 | 2 | 3 | 4 |
| Barwa w stopniach mg Pt/dm3 | 0 | 5 | 10 | 15 | 20 |
| Objętość badanej próbki wody [cm3] | 100 |
| Wzorzec | 2. |
gdzie:
a – odczytana ze skali wzorców barwa próbki, mg Pt/dm³
V – objętość próbki, cm³
Reakcja biuretowa polega na dodaniu do badanej mieszaniny roztworów silnej zasady i siarczanu(VI) miedzi(II). Jeśli w analizowanej próbce znajduje się białko, to roztwór zmienia kolor z niebieskiego na
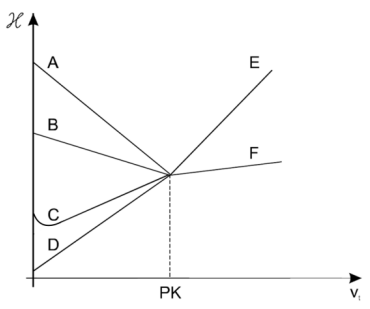
Zawartość kwasu octowego oznaczano alkacymetrycznie, mierząc zmiany przewodnictwa właściwego mieszaniny reakcyjnej w wyniku dodawania roztworu NaOH. Przebieg miareczkowania przedstawiają linie
Ilościowe oznaczanie składnika w badanym roztworze za pomocą metody miareczkowej polega na
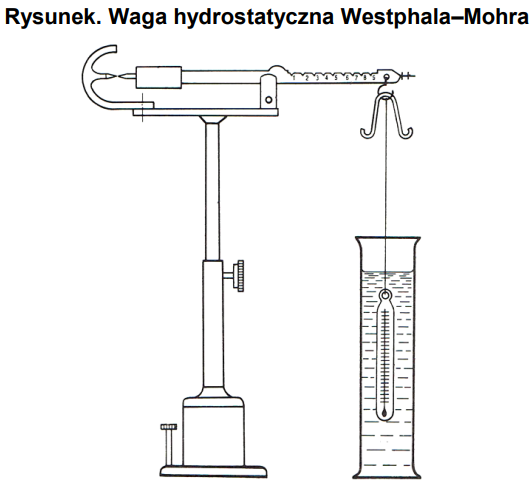
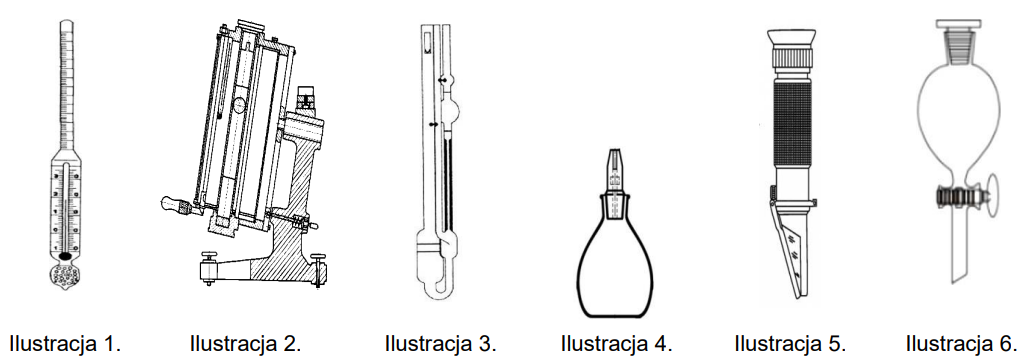
Którą właściwość fizyczną substancji można wyznaczyć za pomocą przyrządu przedstawionego na rysunku?
Zielonkawo lub żółtozielono zabarwiony płomień palnika sygnalizuje obecność jonów
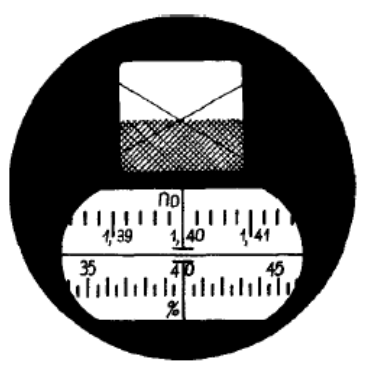
Przed każdym pomiarem pryzmaty refraktometru powinny być starannie oczyszczone
Jakie cechy powinien mieć preparat mikroskopowy?
Część opisu skutków analizy
(...) generuje kation jednowartościowy, a sole powstałe z tym kationem to w przeważającej mierze substancje trudnorozpuszczalne. Większość jego soli jest bezbarwna. Ten bezbarwny jon ma zdolność do tworzenia jonów kompleksowych, na przykład z tiosiarczanem sodowym. Związki tego kationu są wrażliwe na światło (ciemnieją pod jego działaniem), dlatego powinny być przechowywane w pojemnikach z ciemnego szkła (...) Z opisu wynika, że w analizowanym surowcu jakościowo oznaczano kation
Do zmiareczkowania 30,0 cm3 roztworu HCl o stężeniu 0,1 mol/dm3 użyto KOH. Jaką masę KOH zawierała ta odważka?
MKOH = 56 g/mol
W tabeli przedstawiono fragment opisu parametrów
| Zakresy pomiarowe | Przewodnictwo: 0,01 µS/cm÷500 mS/cm Zasolenie: 0,0÷1999 mg/l NaCl 2.0÷50,0 g/l NaCl |
| Błąd pomiaru (± 1 cyfra) | Przewodnictwo ≤ 0,5%, Zasolenie ≤ 0,5%, |
| Temperatura odniesienia | 20 lub 25°C. Ustawienie fabryczne: 25°C |
| Warunki otoczenia | Temperatura pracy: 0°C do 50°C, temperatura przechowywania: -15°C do 65°C, 80% wilgotności względnej (bez kondensacji) |
W literaturze chromatografię określa się skrótem GC
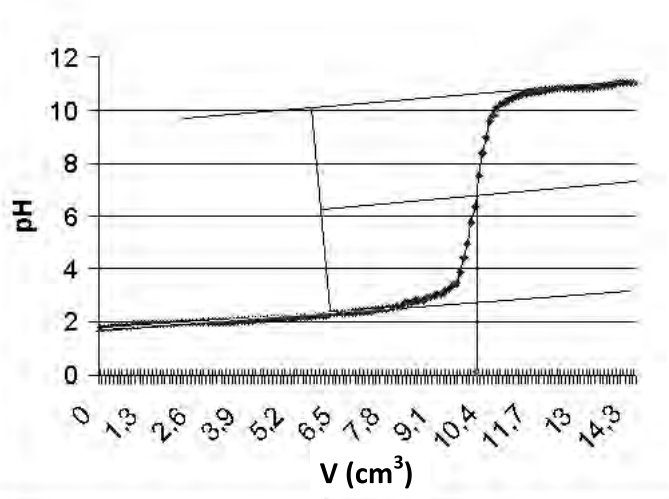
Przedstawioną na rysunku krzywą wyznaczono przy pomocy
Rodzaj chromatografii, w której rozdzielanie składników następuje na podstawie różnic w rozpuszczalności osadów formujących się w wyniku reakcji między jonami w roztworze a osadzonym na nośniku reagentem strącającym, określa się mianem chromatografii
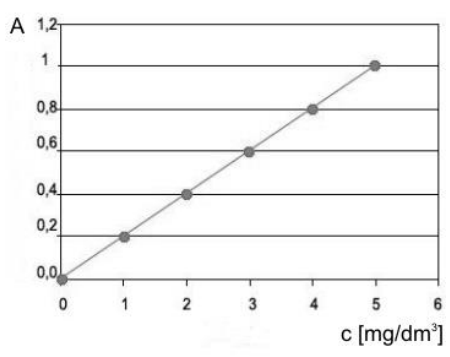
Korzystając z krzywej wzorcowej, określ stężenie badanej próbki, jeżeli absorbancja wynosi 0,6.
Jaką metodę analizy ilościowej wykorzystuje się do oznaczania stężenia nadtlenku wodoru w 3% roztworze wody utlenionej?
Na podstawie informacji zamieszczonych w tabeli wskaż wzór związku, który wytrąci się w postaci osadu.
| Badany kation | Odczynnik grupowy | NaOH | Barwienie płomienia |
|---|---|---|---|
| Mg2+ | brak | biały osad | |
| K+ | brak | fiołkowy | |
| Na+ | brak | żółty |
Analiza składników chemicznych próbki substancji organicznej odbywa się w badaniu
Na podstawie zamieszczonego schematu ilustrującego przeprowadzone badania wskaż, jaką barwę przyjmie roztwór w probówce oznaczonej numerem 2.
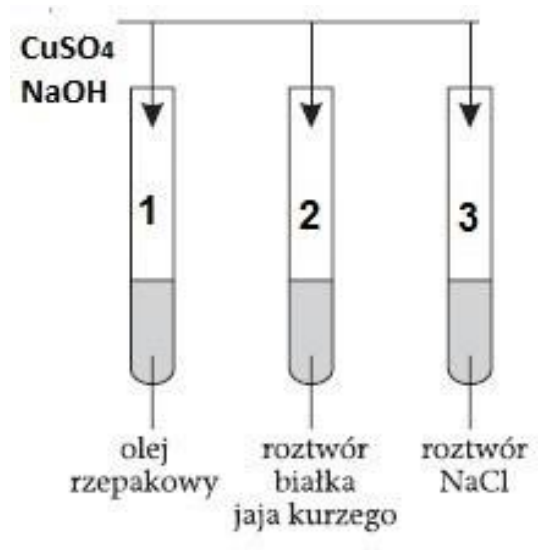
Przeprowadzano analizę jakościową próbki według schematu:
Badana próbka zawierała kation
| badany roztwór zawierający jony X2+ | |
| + roztwór HCl | |
| XCl2↓ biały osad | |
| + H2O: ogrzać | |
| roztwór X2+: podzielić na 2 części | |
| + roztwór KI | oziębić |
| XI2 żółty osad | XCl2↓ biały osad |
W tabeli przedstawiono potencjały normalne niektórych układów redox Metodą jodometryczną pośrednią ilościowo można oznaczyć
| Układ redox | Potencjał normalny [V] |
|---|---|
| I2 + 2 e- ⟷ 2 I- | 0,55 |
| Pb2+ + 2 e- ⟷ Pb0 | -0,13 |
| Sn2+ + 2 e- ⟷ Sn0 | 0,15 |
| Bi3+ + 3 e- ⟷ Bi0 | 0,23 |
| Fe3+ + 1 e- ⟷ Fe2+ | 0,77 |
Liczba wskazująca ilość (w mg) KOH potrzebną do zneutralizowania wolnych kwasów tłuszczowych obecnych w badanym tłuszczu, to liczba
Wygięty pręt wykonany ze szkła, metalu lub plastiku, który służy do przeprowadzania posiewów na powierzchni i rozprowadzania materiału biologicznego, jest w mikrobiologii określany jako
Wykonano jodometryczne oznaczenie zawartości kwasu askorbinowego dla 4 próbek tabletek witaminy C, uzyskując wyniki:
Na podstawie informacji zawartych w opisie i wyników analizy można stwierdzić, że zawartość witaminy C
| Próbka | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Zawartość kwasu askorbinowego | 198,5 mg | 211 mg | 201 mg | 205 mg |
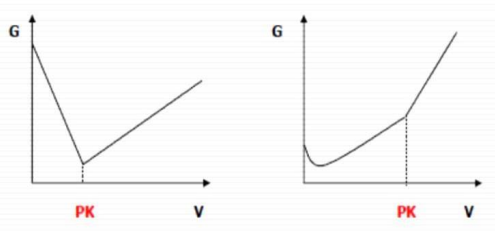
Wykresy przedstawiają przebieg krzywych miareczkowania
Pomiarów wykonywanych z użyciem wysokosprawnego chromatografu cieczowego dokonuje się w ramach
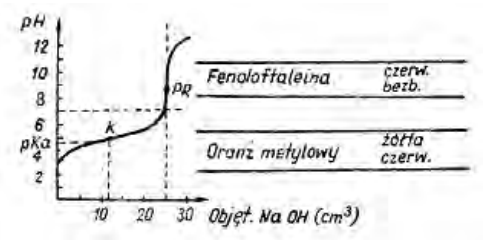
Zamieszczony wykres przedstawia krzywą miareczkowania
Piknometr umożliwia określenie
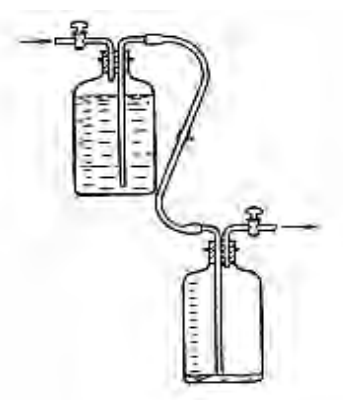
Na których ilustracjach są przedstawione przyrządy służące do wyznaczania gęstości cieczy?
Na rysunku przedstawione jest pole widzenia
Zjawisko dzielenia się składników mieszaniny pomiędzy fazę stacjonarną a ruchomą w układzie to proces widoczny w
Jakie sole nie podlegają procesowi hydrolizy?
Jakie składniki odżywcze w żywności są identyfikowane za pomocą odczynników Fehlinga I i II?
Jaką metodę można wykorzystać do oznaczania białek w produktach żywnościowych?
Na rysunku przedstawiono wykonanie analizy metodą
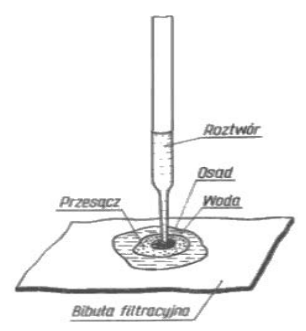
W celu identyfikacji cukru przeprowadzono następujące doświadczenia:
Identyfikowanym cukrem jest
| Doświadczenie | Wynik doświadczenia |
|---|---|
| Próba Trommera | pozytywna |
| Próba Tollensa | pozytywna |
| Hydroliza | nie zachodzi |
Przy pomocy zamieszczonego na rysunku urządzenia można oznaczyć