Pytanie 1
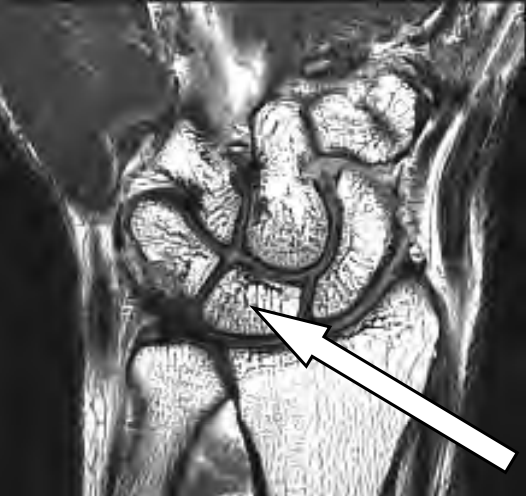
Na obrazie RM nadgarstka lewego strzałką oznaczono kość
Wynik: 20/40 punktów (50,0%)
Wymagane minimum: 20 punktów (50%)
Na obrazie RM nadgarstka lewego strzałką oznaczono kość

W obrazowaniu MR wykorzystuje się moment magnetyczny
Który załamek odzwierciedla repolaryzację komór w zapisie EKG?
W zapisie EKG załamek U występuje bezpośrednio po załamku
W radiografii mianem SID określa się
Którą strukturę anatomiczną oznaczono na zamieszczonym obrazie rezonansu magnetycznego?
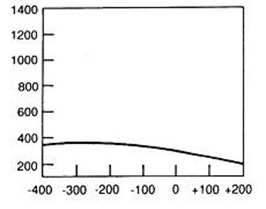
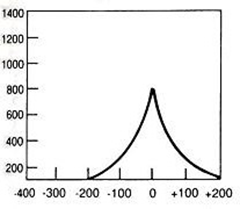
Który wynik badania tympanometrycznego potwierdza, że słuch badanego pacjenta jest w granicach normy?
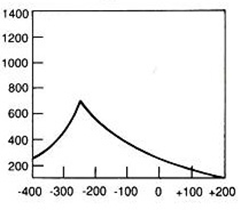
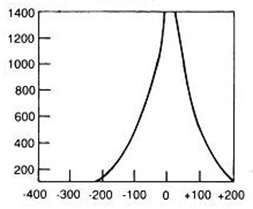
Największa wartość energii promieniowania stosowanego w radioterapii jest generowana przy użyciu
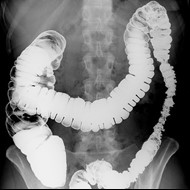
Przedstawiony obraz radiologiczny został zarejestrowany podczas badania jelita
Zadaniem technika elektroradiologii w pracowni badań naczyniowych jest
Czas repetycji w obrazowaniu metodą rezonansu magnetycznego to
Zgodnie z procedurą wzorcową w badaniu MR należy ułożyć pacjenta na brzuchu do diagnostyki
W medycznym przyspieszaczu liniowym jest generowana wiązka fotonów o energii w zakresie
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
Cholangiografia to badanie radiologiczne
Jednym z kryteriów poprawnie wykonanego badania spirometrycznego jest czas trwania natężonego wydechu, który powinien wynosić u osób powyżej 10 roku życia co najmniej
W ułożeniu do rentgenografii AP stawu kolanowego promień główny pada
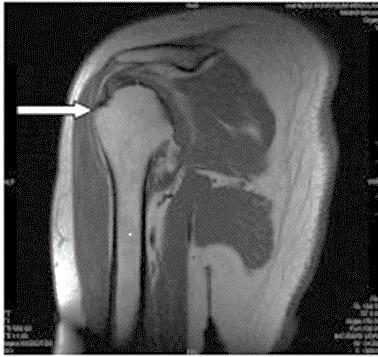
Którą strukturę anatomiczną oznaczono strzałką na obrazie rezonansu magnetycznego?
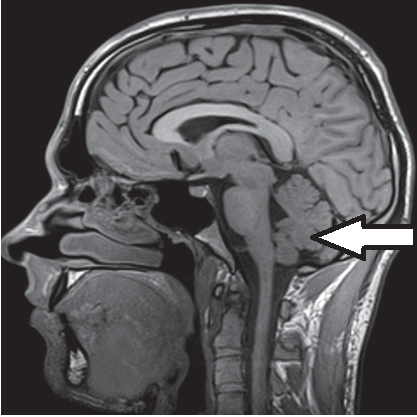
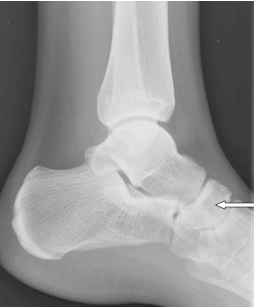
Na radiogramie strzałką oznaczono
W celu wyeliminowania zakłóceń obrazu MR przez sygnały pochodzące z tkanki tłuszczowej, stosuje się
Limfografia to badanie kontrastowe
Badanie cewki moczowej polegające na wstecznym wprowadzeniu środka kontrastowego to
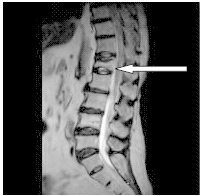
Na obrazie rezonansu magnetycznego strzałką oznaczono patologiczny kręg
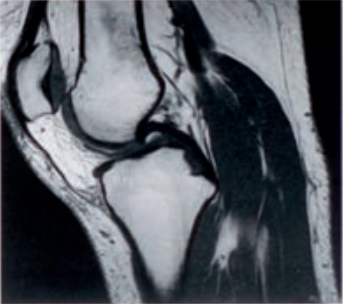
Którą metodę badania zastosowano w obrazowaniu stawu kolanowego?
Rak drobnokomórkowy i rak niedrobnokomórkowy to postacie organiczne nowotworów złośliwych
W scyntygrafii dynamiczne badanie najczęściej rozpoczyna się
Gadolin jako dożylny środek kontrastowy stosowany w MR powoduje
W których projekcjach wykonuje się standardowe badanie mammograficzne?
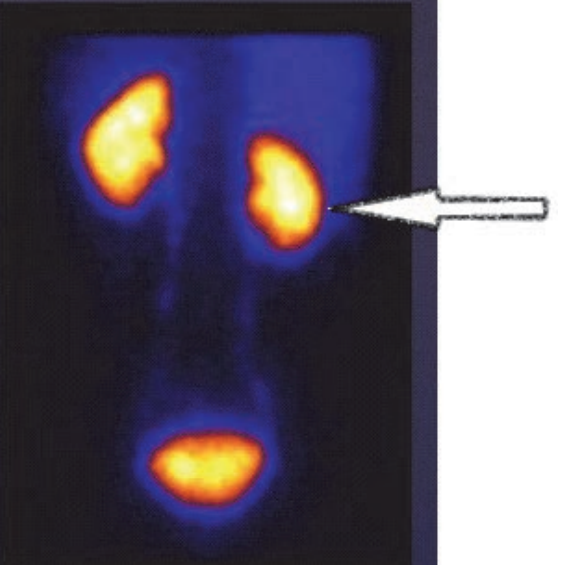
Na scyntygramie strzałką oznaczono
„Ognisko zimne” w obrazie scyntygraficznym określa się jako
Który załamek w zapisie EKG odpowiada zjawisku depolaryzacji przedsionków mięśnia sercowego?
W standardowym badaniu elektrokardiologicznym elektrodę C4 należy umocować
Zamieszczony elektrokardiogram przedstawia
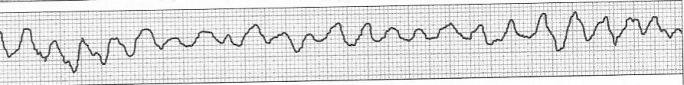
Wskazaniem do wykonania scyntygrafii perfuzyjnej jest
W scyntygrafii serca metoda bramkowanej akwizycji SPECT umożliwia między innymi ocenę frakcji wyrzutowej
Podczas którego badania zostały zarejestrowane przedstawione obrazy?
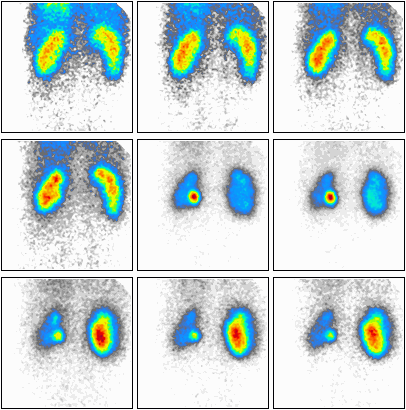
Który załamek odzwierciedla szybką repolaryzację komór w zapisie EKG?
W badaniu EKG elektrodę przedsercową V4 należy umocować
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
W obrazowaniu metodą rezonansu magnetycznego T1 oznacza czas