Pytanie 1
Kto jest odpowiedzialny za wykonywanie testów podstawowych kontroli jakości gammakamery w Zakładzie Medycyny Nuklearnej?
Wynik: 26/40 punktów (65,0%)
Wymagane minimum: 20 punktów (50%)
Kto jest odpowiedzialny za wykonywanie testów podstawowych kontroli jakości gammakamery w Zakładzie Medycyny Nuklearnej?
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
Który radioizotop jest emiterem promieniowania alfa?
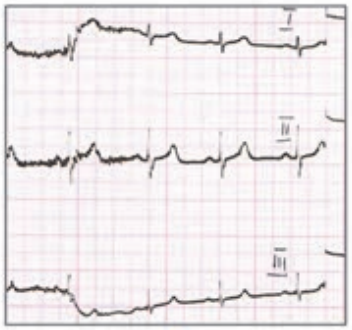
Pojawienie się w zapisie EKG patologicznego załamka Q lub QS może wskazywać na
Obrazowanie portalowe w radioterapii służy do
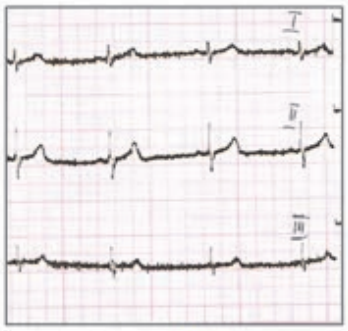
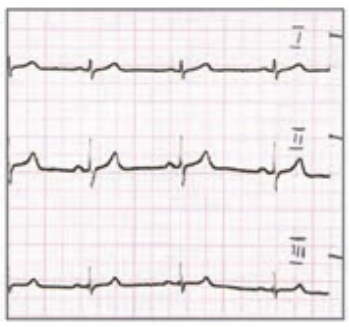
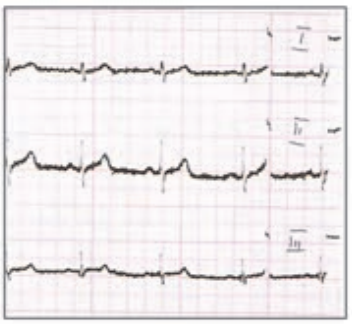
Który elektrokardiogram jest poprawny technicznie?
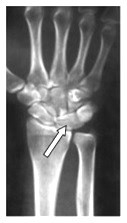
Na obrazie radiologicznym nadgarstka strzałką zaznaczona jest kość
Standardowe badanie urografii polega na podaniu pacjentowi środka kontrastującego
Jak określa się rekonstrukcję obrazów TK, której wynikiem są obrazy dwuwymiarowe tworzone w dowolnej płaszczyźnie przez wtórną obróbkę zestawionych ze sobą wielu przekrojów poprzecznych?
Zgodnie ze standardami do wykonania zdjęcia bocznego czaszki, należy zastosować kasetę o wymiarze
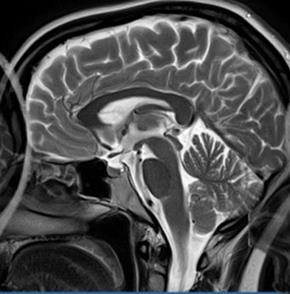
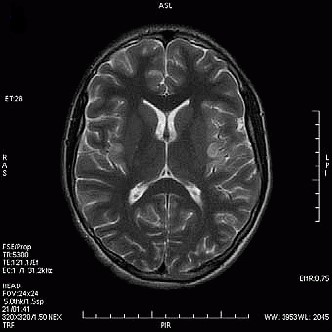
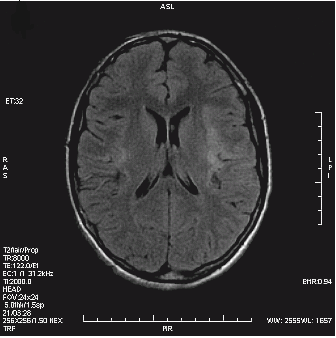
Która przyczyna spowodowała powstanie artefaktu widocznego na zamieszczonym obrazie MR?
Które odprowadzenie w badaniu EKG rejestruje różnice potencjałów pomiędzy lewym a prawym przedramieniem?
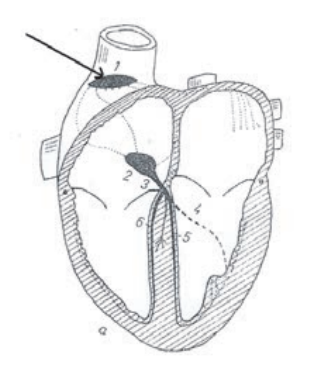
Strzałką na schemacie oznaczono
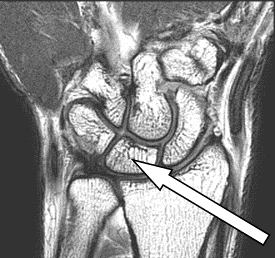
Na zamieszczonym obrazie RM nadgarstka lewego strzałką wskazano kość
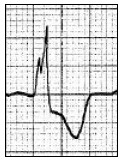
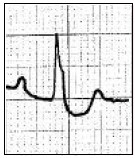
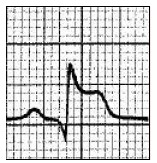
Który zapis EKG przedstawia falę Pardee'go?

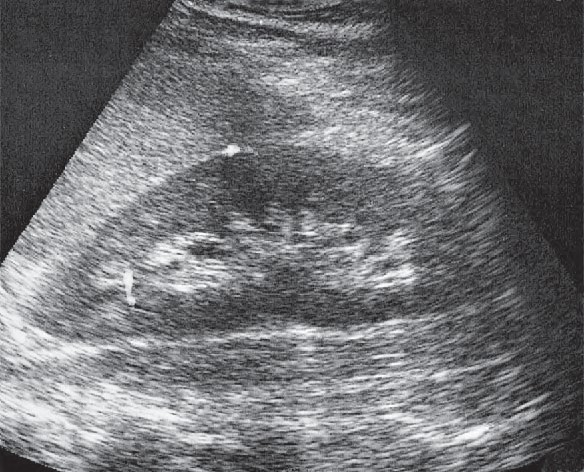
Który narząd widoczny jest na wydruku badania ultrasonograficznego?
Zamieszczone obrazy związane są z badaniem
W systemie międzynarodowym czwarty górny ząb mleczny po stronie prawej oznacza się symbolem
Przy podejrzeniu ciała obcego w oczodole należy wykonać
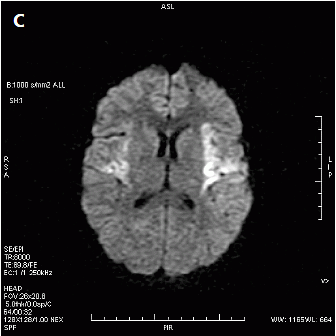
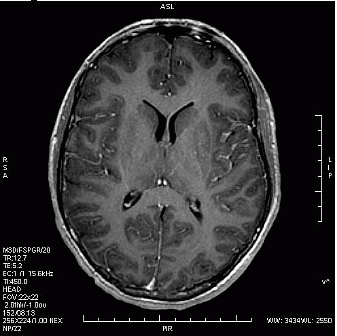
Który obraz MR mózgu został wykonany w sekwencji DWI?
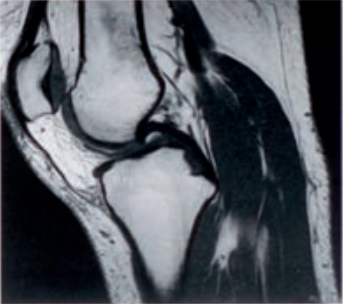
Którą metodę badania zastosowano w obrazowaniu stawu kolanowego?
Promieniowanie rentgenowskie jest
Nieostrość geometryczna obrazu rentgenowskiego zależy od
W zapisie EKG załamki P dodatnie w odprowadzeniu I i II, a ujemne w aVR oraz częstotliwość rytmu mniejsza niż 60/min wskazują na
W standardowym badaniu EEG elektrody P3, P4 i Pz umieszcza się na skórze głowy pacjenta nad płatami
Na zamieszczonym rentgenogramie strzałką zaznaczono
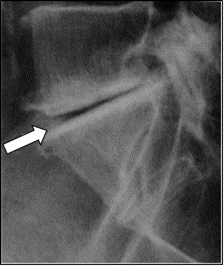
Jaki czas należy ustawić do wykonania zdjęcia rentgenowskiego dwójki górnej lewej?
| Tabela ekspozycji | |||
|---|---|---|---|
| wartości | czasu (s) | napięcia (kV) | natężenia (mA) |
| zęby przedtrzonowe i kły | 0,160 | 60 | 8 |
| siekacze | 0,120 | 60 | 8 |
| zęby trzonowe | 0,200 | 60 | 8 |
| ekspozycja zgryzowo-skrzydełkowa | 0,180 | 66 | 6 |
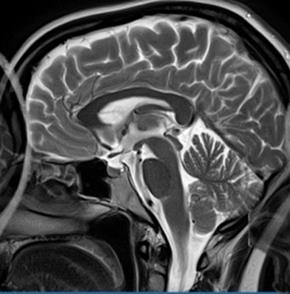
Wskaż przyczynę powstania artefaktu widocznego na obrazie MR.
W badaniu audiometrycznym do oceny przewodnictwa kostnego wybranego ucha słuchawkę kostną należy przyłożyć do
Kryterium rozpoznawczym dla fali δ (delta) w badaniu EKG jest
SPECT to
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
W diagnostyce mammograficznej punktowy ucisk sutka stosuje się w projekcji
Podczas badania EEG otwarcie oczu powoduje
Która metoda leczenia onkologicznego zaliczana jest do leczenia systemowego?
Które badanie, zgodnie z zakresem kompetencji, może samodzielnie wykonać technik elektroradiolog?
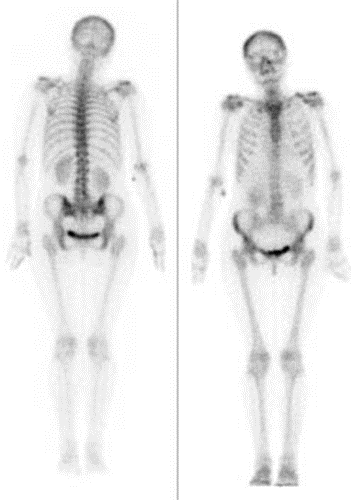
Przedstawiony obraz został zarejestrowany podczas wykonania
W badaniu EEG w systemie „10-20” elektrody w okolicy skroniowej oznaczone są literą
Wyniosłość międzykłykciowa znajduje się na nasadzie
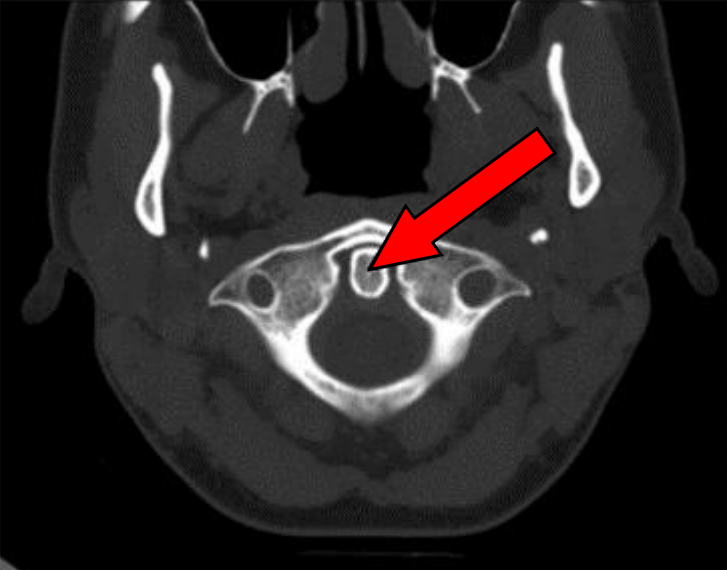
Na przekroju poprzecznym TK kręgosłupa szyjnego strzałką wskazano