Pytanie 1
Który obszar napromieniania w radioterapii oznacza się skrótem PTV?
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Który obszar napromieniania w radioterapii oznacza się skrótem PTV?
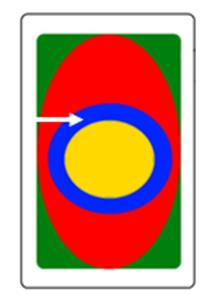
Który obszar napromieniania wskazano na ilustracji strzałką?
Jaka jest moc dawki pochłoniętej w brachyterapii HDR?
Dawka graniczna wyrażona jako dawka skuteczna (efektywna), dla osób zawodowo narażonych na działanie promieniowania jonizującego wynosi w ciągu roku kalendarzowego
Promieniowanie jonizujące pośrednio to
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
Warstwa półchłonna (WP) jest wyrażona w mm Cu dla
W medycznym przyspieszaczu liniowym jest generowana wiązka fotonów o energii w zakresie
Co określa M₀ w systemie klasyfikacji nowotworów TNM?
Celem radioterapii paliatywnej nie jest
Skrótem CTV w radioterapii oznacza się
Obrazowanie portalowe w radioterapii służy do
Wskazaniem do zastosowania brachyterapii w leczeniu radykalnym jest rak
Wskaż roczną dawkę graniczną dla osób zatrudnionych w warunkach narażenia na promieniowanie jonizujące.
Źródłem promieniowania protonowego stosowanego w radioterapii jest
Czym charakteryzuje się późny odczyn popromienny?
Jakie wiązki promieniowania emituje medyczny akcelerator liniowy?
Do wczesnych odczynów popromiennych po radioterapii zalicza się
Która metoda leczenia onkologicznego zaliczana jest do leczenia systemowego?
Jakie są wielkości mocy dawki stosowanej w brachyterapii HDR?
Największa wartość energii promieniowania stosowanego w radioterapii jest generowana przy użyciu
Kolimator wielolistkowy w akceleratorze liniowym jest stosowany do
Hiperfrakcjonowanie dawki w teleradioterapii polega na napromienianiu 2 do 3 razy dziennie dawką frakcyjną
Elementem pomocniczym w radioterapii, zapewniającym powtarzalność ułożenia w pozycji terapeutycznej, a także unieruchomienie pacjenta, jest
Warstwa półchłonna (WP) służy do obliczania
Jaka jest odległość pomiędzy źródłem promieniowania a powierzchnią ciała pacjenta w technice izocentrycznej radioterapii?
W pracowni radioterapii wyświetlenie na ekranie monitora aparatu komunikatu „ROTATION” oznacza prowadzoną terapię
Które urządzenia pomocnicze służą do unieruchomienia pacjenta do zabiegu radioterapii?
Który radioizotop jest stosowany w diagnostyce i terapii raka tarczycy?
Jakie wymagania techniczne muszą spełniać aparaty terapeutyczne stosowane w zakładach brachyterapii, służące bezpośrednio do napromieniania pacjenta metodą zdalnego wprowadzania źródeł promieniotwórczych?
Wiązka elektronów najczęściej stosowana jest do leczenia zmian nowotworowych w obrębie
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
W brachyterapii MDR stosowane są dawki promieniowania
Jak oznacza się w radioterapii obszar tkanek zawierający GTV i mikrorozsiewy w fazie niewykrywalnej klinicznie?
Do czego służy do symulator rentgenowski wykorzystywany w procesie radioterapii?
Technika stereotaktyczna polega na napromienianiu nowotworu
W technice napromieniania SSD mierzona jest odległość źródła promieniowania
Teleterapia polega na napromienowaniu
Jak konwencjonalnie frakcjonuje się dawkę w teleradioterapii?
Obrazy DDR są tworzone w trakcie