Pytanie 1
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Zgodnie z procedurą wzorcową w badaniu MR należy ułożyć pacjenta na brzuchu do diagnostyki
Do zdjęcia lewobocznego kręgosłupa lędźwiowo-krzyżowego pacjenta należy ułożyć na boku
Podczas wykonywania zdjęcia rentgenowskiego klatki piersiowej w celu ochrony radiologicznej pacjenta należy zastosować
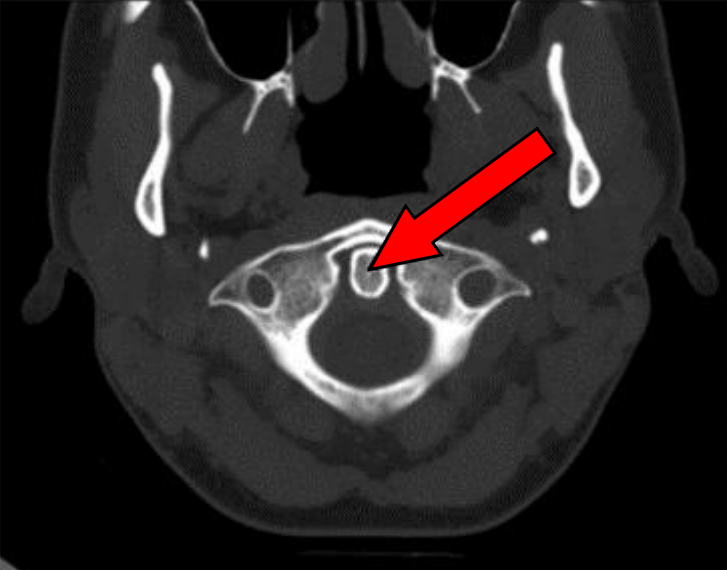
Na przekroju poprzecznym TK kręgosłupa szyjnego strzałką wskazano
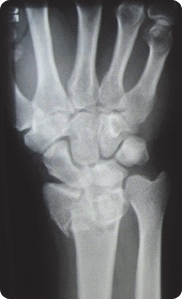
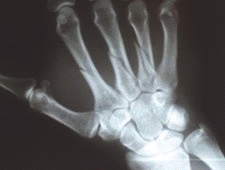
Na obrazie rentgenowskim strzałką zaznaczono
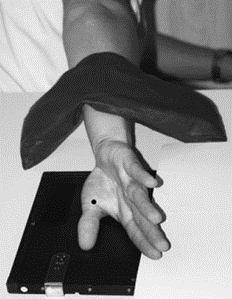
Na ilustracji przedstawiono ułożenie pacjenta do zdjęcia rentgenowskiego
Promieniowanie rentgenowskie jest
Na rentgenogramie przedstawione jest złamanie Saltera-Harrisa typu
W obrazowaniu metodą rezonansu magnetycznego T1 oznacza czas
Na radiogramie uwidoczniono złamanie nasady
W trakcie obrazowania metodą rezonansu magnetycznego wykorzystywane jest zjawisko wysyłania sygnału emitowanego przez
DSA to cyfrowa
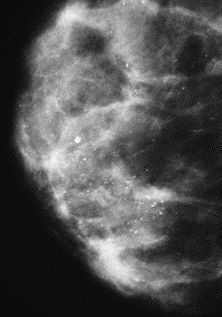
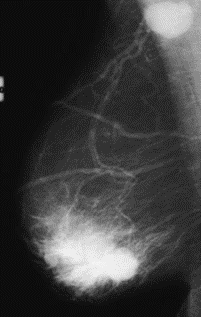
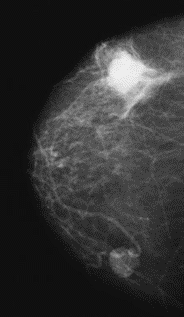
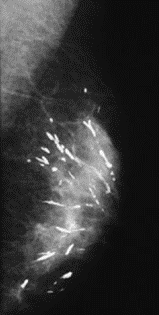
Na którym obrazie rentgenowskim sutka uwidoczniono zmianę patologiczną w obrębie węzłów chłonnych?
Obrazowanie w sekwencjach STIR, FLAIR, SE wykonywane jest w badaniu
Bezwzględnym przeciwwskazaniem do wykonania badania rezonansem magnetycznym jest
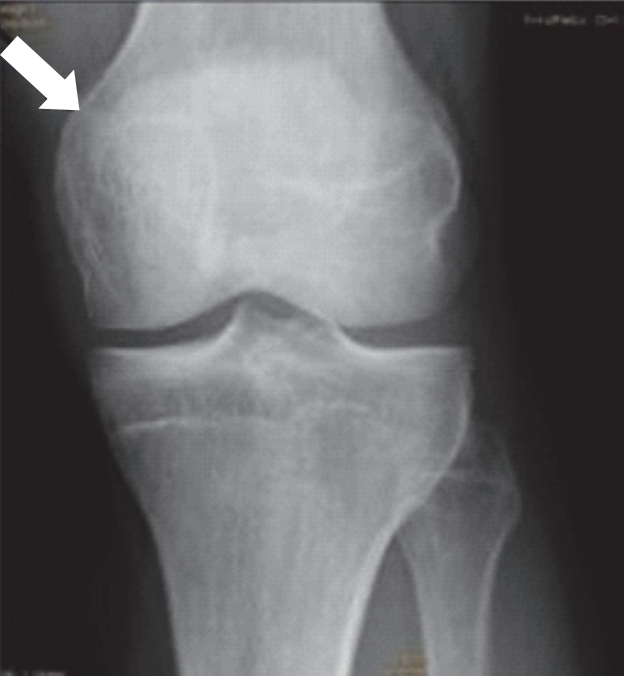
Którą strukturę anatomiczną zaznaczono na radiogramie stawu kolanowego?
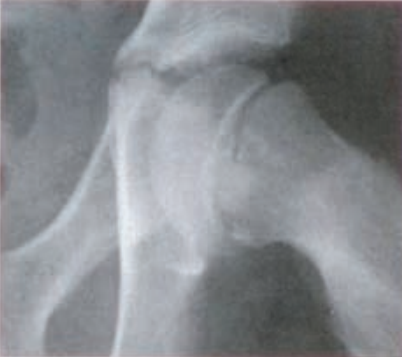
Na radiogramie uwidoczniono złamanie
Osłony na gonady dla osób dorosłych powinny posiadać równoważnik osłabienia promieniowania nie mniejszy niż
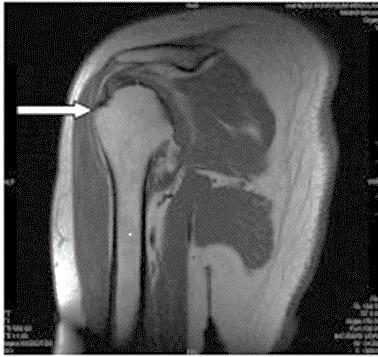
Którą strukturę anatomiczną oznaczono na zamieszczonym obrazie rezonansu magnetycznego?
Na przekroju poprzecznym rezonansu magnetycznego strzałką oznaczono
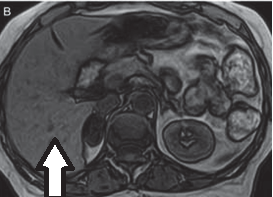
Obraz stawu kolanowego otrzymano metodą
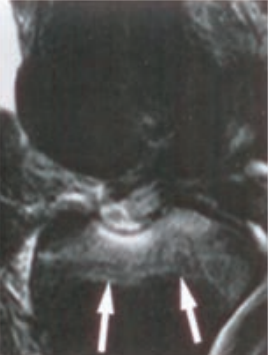
Dobierz dla standardowego pacjenta projekcję, pozycję i sposób ułożenia kasety o wymiarach 30 cm x 40 cm do zdjęcia przeglądowego układu moczowego.
| Projekcja | Pozycja | Ułożenie kasety | |||
|---|---|---|---|---|---|
| 1. | AP | 3. | stojąca | 5. | poprzeczne |
| 2. | PA | 4. | leżąca | 6. | podłużne |
Zwiększenie napięcia na lampie rentgenowskiej powoduje
Jak określa się rekonstrukcję obrazów TK, której wynikiem są obrazy dwuwymiarowe tworzone w dowolnej płaszczyźnie przez wtórną obróbkę zestawionych ze sobą wielu przekrojów poprzecznych?
HRCT (high-resolution computed tomography) jest metodą obrazowania TK
Po podaniu kontrastu obraz zmian nowotworowych w badaniu MR najlepiej uwidacznia się w sekwencji
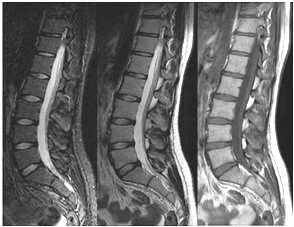
Które kolejne sekwencje badania kręgosłupa lędźwiowego uwidoczniono na przedstawionych obrazach?
Która sekwencja obrazowania MR wykorzystuje impulsy RF o częstotliwości rezonansowej tłuszczu do tłumienia sygnału pochodzącego z tkanki tłuszczowej?
Do zdjęcia rentgenowskiego żeber w projekcji skośnej tylnej pacjenta należy ustawić
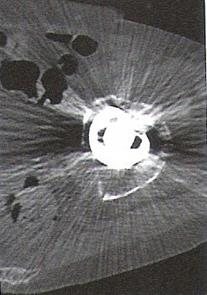
Zarejestrowany na obrazie TK artefakt jest spowodowany
Zadaniem technika elektroradiologa w pracowni naczyniowej jest
Jak zgodnie ze standardem należy ustawić pacjenta do badania rentgenowskiego w skosie tylnym prawym?
Która struktura może być oknem akustycznym w badaniu ultrasonograficznym?
W diagnostyce mammograficznej punktowy ucisk sutka stosuje się w projekcji
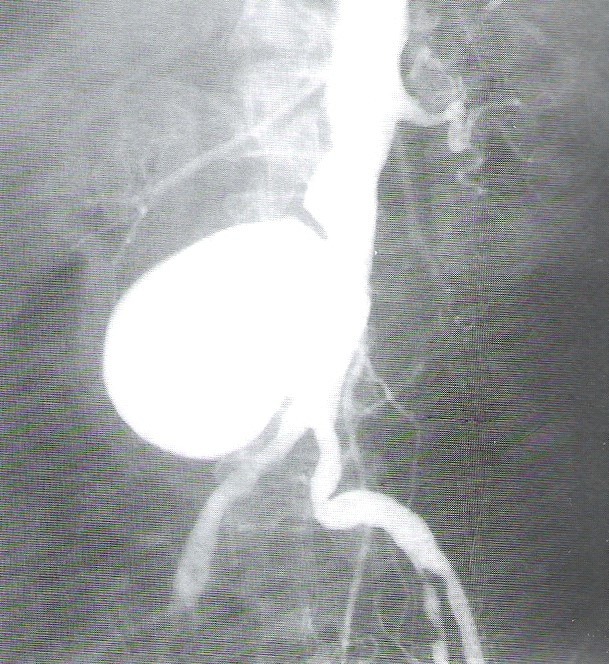
Pielografia zstępująca umożliwia diagnostykę
Badanie gęstości mineralnej kości metodą DXA należy wykonać
Zgodnie z procedurą wzorcową w badaniu MR należy ułożyć pacjenta na brzuchu do diagnostyki
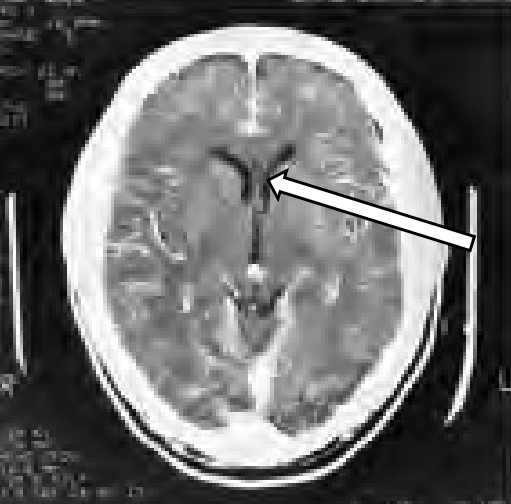
Którą strukturę anatomiczną oznaczono na skanie TK głowy?
Parametrem krwi, który powinien zostać oznaczony u pacjenta przed wykonaniem badania MR z kontrastem, jest