Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 29/40 punktów (72,5%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W trakcie kalibracji stężenia roztworu kwasu solnego na przynajmniej przygotowany roztwór zasady sodowej ma miejsce reakcja
Sód powinien być przechowywany
Aby ustalić miano roztworu wodnego NaOH, należy zastosować
Jaką objętość roztworu NaOH o stężeniu 1 mol/dm3 należy użyć, aby przygotować 50 cm3 roztworu NaOH o stężeniu 0,4 mol/dm3?
Sporządzono 250 cm3 roztworu glicerolu o gęstości 1,05 g/cm3 w temperaturze 20°C. Korzystając z danych zamieszczonych w tabeli, określ stężenie procentowe sporządzonego roztworu glicerolu.
| Glicerolu [%] | 10% | 20% | 30% | 50% |
|---|---|---|---|---|
| d20 [g/dm3] | 1023,70 | 1048,40 | 1073,95 | 1127,20 |
W wyniku reakcji 100 g azotanu(V) ołowiu(II) z jodkiem potasu otrzymano 120 g jodku ołowiu(II). Wydajność reakcji wyniosła
| Pb(NO3)2 + 2KI → PbI2 + 2KNO3 | |
| (MPb(NO3)2 = 331 g/mol, MKI = 166 g/mol, MPbI2 = 461 g/mol, MKNO3 = 101 g/mol) |
Aby w badanej próbie w trakcie zmiany pH nastąpiła zmiana barwy na malinową, należy użyć
| Zmiany barw najważniejszych wskaźników kwasowo-zasadowych | ||||
|---|---|---|---|---|
| Wskaźnik | Barwa w środowisku | Zakres pH zmiany barwy | ||
| Kwasowym | Obojętnym | Zasadowym | ||
| oranż metylowy | czerwona | żółta | żółta | 3,2÷4,4 |
| lakmus (mieszanina substancji) | czerwona | fioletowa | niebieska | 4,5÷8,2 |
| fenoloftaleina | bezbarwna | bezbarwna | malinowa | 8,2÷10,0 |
| wskaźnik uniwersalny (mieszanina substancji) | czerwona (silnie kwaśne) pomarańczowa (słabo kwaśne) | żółta | niebieska (silnie zasadowe) zielona (słabo zasadowe) | co jeden stopień skali |
| herbata | żółta | czerwona-brunatna | brązowa | |
| sok z czerwonej kapusty | fioletowa | niebieska | zielona | |
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
Na rysunku numerami rzymskimi oznaczono
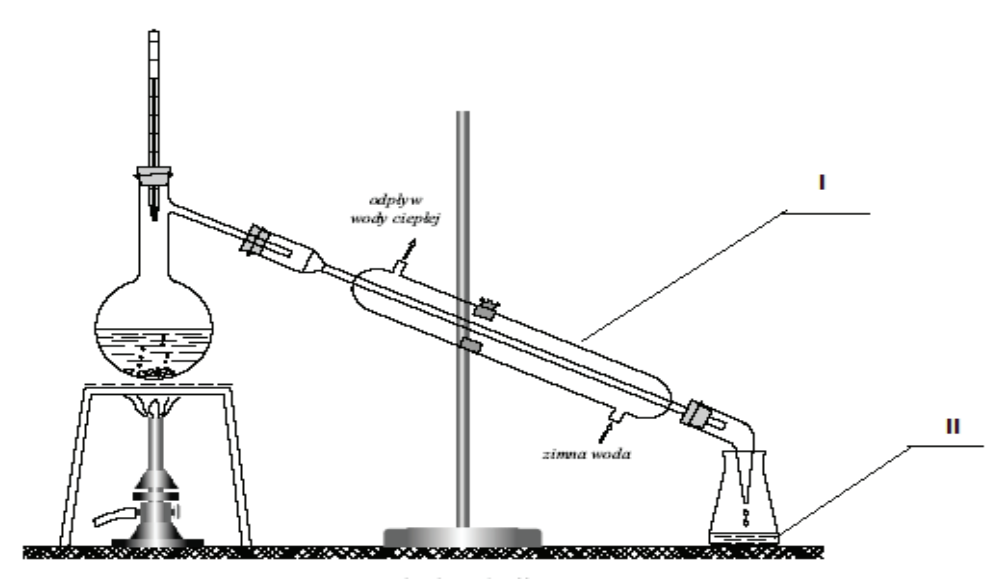
Jakie zestawienie sprzętu laboratoryjnego wykorzystuje się do filtracji osadów?
Jakie środki należy zastosować do gaszenia pożaru metali, takich jak magnez, sód czy potas?
Jaki jest błąd względny pomiaru na wadze o precyzji 0,1 g dla próbki o wadze 1 g?
Po zakończeniu pomiarów pH, elektrody powinny być przepłukane
Symbol "In" znajduje się na
Zgodnie z zasadami BHP w laboratorium, po zakończeniu pracy z odczynnikami chemicznymi należy:
Próbki pobrano z materiału o objętości \( 100 \, \text{m}^3 \), wysypanego z opakowania. Liczba miejsc poboru próbek pierwotnych z tego materiału wynosi:
$$ n = 0{,}5 \cdot \sqrt{V} $$ gdzie:
\( V \) – objętość jednostki badanej w \( \text{m}^3 \)
\( n \) – liczba miejsc poboru próbek
Zestaw przedstawiony na rysunku może służyć do
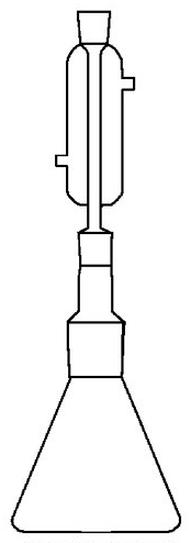
W jakim stosunku objętościowym należy połączyć roztwór o stężeniu 5 mol/dm3 z wodą destylowaną, aby uzyskać roztwór o stężeniu 3 mol/dm3?
Przedstawiony sposób dotyczy pobierania próbki wody do przeprowadzenia badań
| Sposób pobierania próbki wody do przeprowadzenia badań: - próbki pobrać do sterylnych butelek; - przed przystąpieniem do pobierania wody zdjąć z kurka wszelkie urządzenia, zeskrobać zanieczyszczenia, następnie całkowicie otwierając i zamykając zawór, wielokrotnie płukać; - metalowy kurek wysterylizować płomieniem, a kurek z tworzywa sztucznego alkoholem etylowym; - kurek otworzyć do połowy przepływu i spuszczać wodę przez około 2-3 minuty do osiągnięcia stałej temperatury; - pobrać próbkę wody napełniając butelkę do około ¾ objętości i natychmiast zamknąć korkiem. |
W wypadku oblania skóry kwasem mrówkowym należy
| Wyciąg z karty charakterystyki Skład: kwas mrówkowy 80%, woda 11-20% Pierwsza pomoc. Po narażeniu przez drogi oddechowe. Natychmiast wezwać lekarza. Po kontakcie ze skórą. Zanieczyszczoną skórę natychmiast przemyć dużą ilością wody. |
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
Brak odpowiedzi na to pytanie.
Przedstawiony zestaw stosowany jest w laboratorium do przeprowadzenia procesu
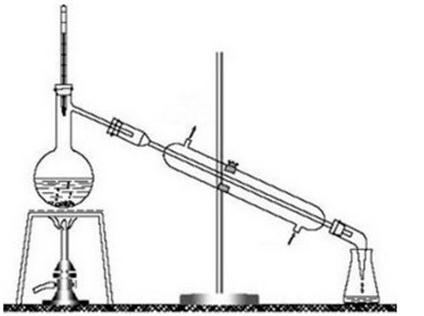
Na rysunku przedstawiono zestaw do
Wodę do badań mikrobiologicznych powinno się pobierać do butelek
Naczynia miarowe kalibrowane "na wlew" mają oznaczenie w postaci symbolu
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Jaka minimalna pojemność powinna mieć miarka, aby jednorazowo zmierzyć 60,0 cm3 wody?
Aby przyspieszyć reakcję, należy zwiększyć stężenie substratów
Próbkę laboratoryjną dzieli się na dwie części, ponieważ
Procedura oznaczenia kwasowości mleka. Do wykonania analizy, zgodnie z powyższą procedurą, potrzebne są
| Do kolby stożkowej o pojemności 300 cm3 pobrać dokładnie 25 cm3 badanego mleka i rozcieńczyć wodą destylowaną do objętości 50 cm3. Dodać 2-3 krople fenoloftaleiny i miareczkować mianowanym roztworem wodorotlenku sodu do uzyskania lekko różowego zabarwienia. |
Jakie urządzenie wykorzystuje się do pomiaru lepkości cieczy?
Jakie czynniki wpływają na zmiany jakościowe w składzie próbki?
Jaką próbkę stanowi woreczek gleby pobranej zgodnie z instrukcją?
| Instrukcja pobierania próbek glebowych | |
| Próbki pierwotne pobiera się laską glebową z wierzchniej warstwy gleby 0-20 cm, kolejno wykonując czynności: – w miejscu pobierania próbki pierwotnej (pojedynczej), rolę świeżo zaoraną przydeptać, – pionowo ustawić laskę do powierzchni gleby, – wcisnąć laskę do oporu (na wysokość poprzeczki ograniczającej), – wykonać pełny obrót i wyjąć laskę, – zawartość wgłębienia (zasobnika) przenieść do pojemnika skrobaczki. Po pobraniu próbek pojedynczych, całość wymieszać i napełnić kartonik lub woreczek. | |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką objętość w warunkach standardowych zajmie 1,7 g amoniaku (masa molowa amoniaku wynosi 17 g/mol)?
Przykładem piany stałej jest
| faza rozproszona | faza rozpraszająca | ||
|---|---|---|---|
| gaz | ciecz | ciało stałe | |
| gaz | - | piana | piana stała |
| ciecz | aerozol ciekły | emulsja | emulsja stała |
| ciało stałe | aerozol stały | zol | zol stały |
Podczas łączenia bezwodnego etanolu z wodą występuje zjawisko kontrakcji. Gdy zmieszamy 1000 cm3 wody oraz 1000 cm3 etanolu, otrzymujemy roztwór o objętości