Pytanie 1
Na podstawie danych w tabelach 1-2 zawierających wartości graniczne wskaźników jakości wody i uzyskane wyniki pomiarowe oceń jakość wody w punktach pomiarowych X i Y, określając jej klasę.
Wynik: 34/40 punktów (85,0%)
Wymagane minimum: 20 punktów (50%)
Na podstawie danych w tabelach 1-2 zawierających wartości graniczne wskaźników jakości wody i uzyskane wyniki pomiarowe oceń jakość wody w punktach pomiarowych X i Y, określając jej klasę.

Jakiego koloru nabierają bakterie Gram—ujemne w trakcie stosowania metody Grama?
Obecność jasnofioletowego zabarwienia płomienia palnika podczas analiz chemicznych wskazuje na obecność w roztworze jonów
Oznaczono LZ i LJ dla czterech różnych próbek tłuszczów. Wyniki zestawiono w tabeli:
Na podstawie zamieszczonych danych o liczbach właściwych wybranych tłuszczów wskaż próbkę, którą stanowi olej rzepakowy.
| Liczby właściwe wybranych tłuszczów | ||
|---|---|---|
| Rodzaj tłuszczu | Liczba zmydlania (LZ) mg KOH / g tłuszczu | Liczba jodowa (LJ) g I₂ / 100 g tłuszczu |
| Olej lniany | 187 – 197 | 169 – 192 |
| Olej sojowy | 188 – 195 | 114 – 138 |
| Olej rzepakowy | 167 – 179 | 94 – 106 |
| Tran wielorybi | 170 – 202 | 102 – 144 |
| Masło krowie | 218 – 245 | 25 – 38 |
| Smalec wieprzowy | 193 – 200 | 46 – 66 |
| Próbka | Liczba zmydlania (LZ) | Liczba jodowa (LJ) |
|---|---|---|
| 1 | 190 | 140 |
| 2 | 171 | 99 |
| 3 | 194 | 105 |
| 4 | 195 | 60 |
Techniką polegającą na mierzeniu siły elektromotorycznej ogniwa składającego się z dwóch elektrod umieszczonych w analizowanym roztworze jest
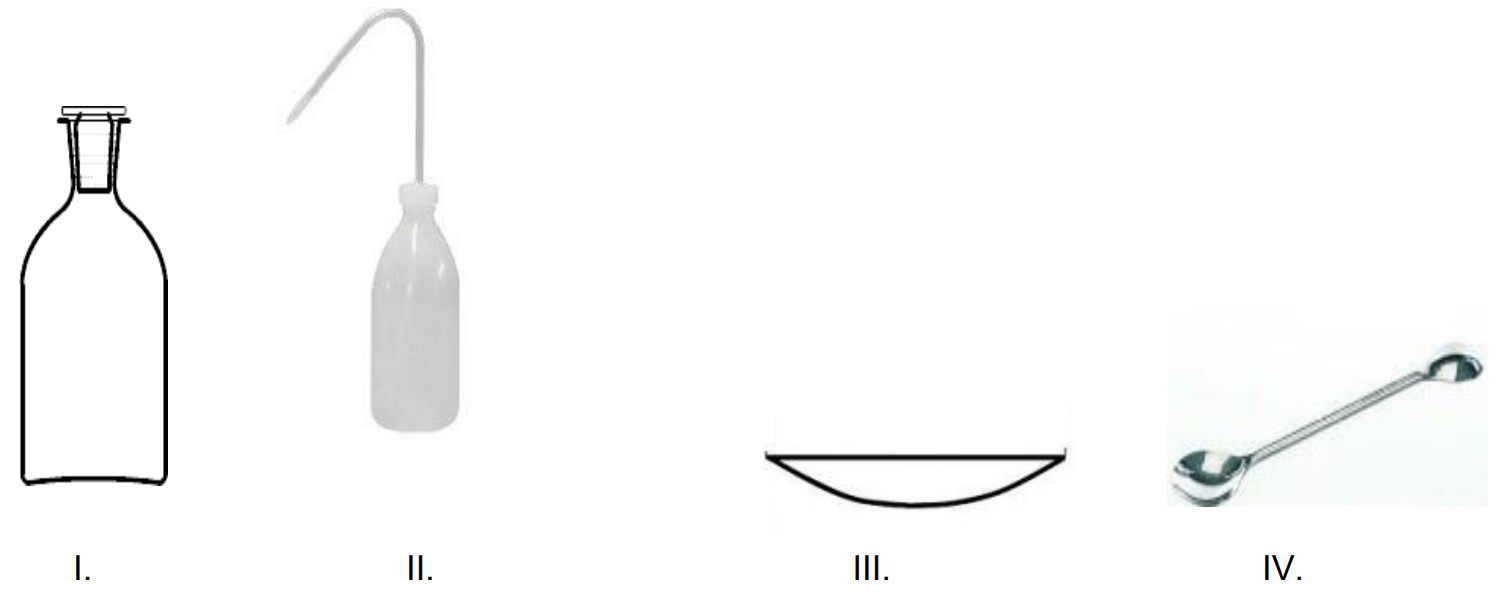
Który ze sprzętów przedstawionych na rysunkach jest niezbędny do przygotowania 250 cm3 mianowanego roztworu NaOH z fiksanalu?
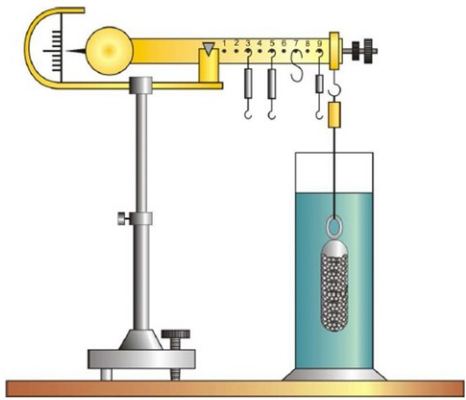
Przedstawiona na rysunku waga Westphala-Mohra służy do badania
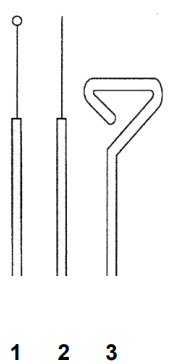
Wskaż nazwy sprzętów laboratoryjnych przedstawionych na rysunku.
Ile miligramów wapnia (MCa = 40,0 g/mol) znajdowało się w analizowanym roztworze, jeśli do zmiareczkowania próbki wykorzystano 20 cm3 0,0100-molowego roztworu EDTA?
W celu przeprowadzenia bezpośredniego testu ELISA należy postąpić zgodnie z procedurą

Dostanie się do środowiska bakterii Salmonella, które były hodowane na pożywkach mikrobiologicznych, może skutkować
Liczba wskazująca ilość (w mg) KOH potrzebną do zneutralizowania wolnych kwasów tłuszczowych obecnych w badanym tłuszczu, to liczba
KOH w formie roztworu jest wykorzystywany jako titrant w analizie żywności do określenia
Aby przygotować podłoże do badań mikrobiologicznych, należy
Jakim urządzeniem określa się temperaturę zapłonu oleju opałowego?
Lepkość oleju napędowego w temperaturze 40°C wynosi 3 mm2/s. Jaką lepkość to określa?
Jaką metodę można wykorzystać do oznaczania cukrów redukujących w owocowych produktach przetworzonych?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Związki lotne, które występują w wielu roślinach i mogą być wydobywane, np. poprzez destylację z parą wodną lub dzięki ciągłej ekstrakcji w aparacie Soxhleta, to
Na schemacie przedstawiono mechanizm działania wskaźników
Jakie pH ma roztwór buforu węglanowego występującego we krwi, którego wartość wynosi 6,6, oraz jaki jest jego odczyn?
Aby zniwelować oddziaływanie wody obecnej w próbce materiału sypkiego na rezultat analizy składu, próbkę należy poddać
Który ze związków będzie barwny w świetle widzialnym?
W temperaturze 40°C lepkość oleju napędowego wynosi 3 mm2/s. Jakiego rodzaju lepkość to reprezentuje?
Uwzględniając zamieszczoną informację, dobierz metodę stosowaną do oznaczania azotanów(V) w wodzie.
| W środowisku stężonego kwasu siarkowego(VI) jony azotanowe(V) ulegają reakcji z salicylanem sodu, dając kwas nitrosalicylowy, który pod wpływem zasad przechodzi w formę zjonizowaną o żółtym zabarwieniu. |
Jaką metodą określa się stężenie cukrów redukujących w produktach owocowych?
Zestaw zawierający palnik gazowy, statyw, łącznik, pierścień, trójkąt ceramiczny oraz tygiel porcelanowy z pokrywką jest stosowany w trakcie oznaczeń
Reakcja ksantoproteinowa umożliwia identyfikację aminokwasu, który zawiera w swojej budowie
Hydroliza sacharozy zachodzi pod działaniem kwasów mineralnych oraz enzymu inwertazy. W wyniku tej reakcji tworzy się mieszanina
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W temperaturze 20°C wyznaczono gęstość i współczynnik załamania światła kwasu butanowego. Wyniki zestawiono w tabeli:
| Gęstość | Współczynnik załamania światła |
|---|---|
| 0,960 g/cm³ | 1,398 |
RM = (n² − 1) · M
(n² + 2) · d
RM – refrakcja molowa, cm³/mol
n – współczynnik załamania światła
d – gęstość, g/cm³
M – masa molowa, 88 g/mol
Czujnik do pomiaru ciśnienia, który na wyjściu generuje sygnał ciągły, działa jako
Wyznacz refrakcję molową (Rm) dla kwasu octowego korzystając z danych zawartych w tabeli.
Rm = ∑a ∙ Ra gdzie: a – liczba atomów jednego rodzaju, Ra – refrakcja atomowa

Ze względu na zmieniającą się podczas miareczkowania objętość badanego roztworu, należy obliczyć poprawkę p w przypadku miareczkowania
| p = Vpróbki + Vwody + Vtitrantu Vpróbki + Vwody |
Na zamieszczonym wykresie cyfrą 2 oznaczono odchylenie

Reakcja jonów SCN- z jonami o krwistoczerwonym zabarwieniu prowadzi do powstawania związków kompleksowych
Podczas miareczkowania kwasu octowego używając roztworu wodorotlenku sodu dochodzi do reakcji
Analiza składników chemicznych próbki substancji organicznej odbywa się w badaniu
Ogólna twardość próbki wody stosowanej w technologiach wynosi 16,5°n, a twardość węglanowa osiąga 7,2°n. Jaką wartość ma twardość stała?
Działanie, które ma na celu określenie relacji pomiędzy wartościami mierzonymi dla wzorcowych próbek a odczytami systemu pomiarowego, realizowane w specyficznych warunkach, to