Pytanie 1
Koronarografia jest radiologicznym zabiegiem diagnostycznym pozwalającym ocenić drożność
Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Koronarografia jest radiologicznym zabiegiem diagnostycznym pozwalającym ocenić drożność
W obrazowaniu metodą rezonansu magnetycznego T1 oznacza czas
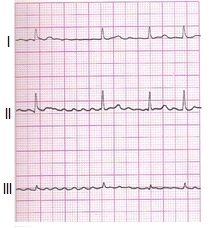
Zamieszczone badanie elektrokardiograficzne wykazało u pacjenta
Zgodnie ze standardami do wykonania zdjęcia bocznego czaszki, należy zastosować kasetę o wymiarze
Zastosowana w badaniu radiologicznym kratka przeciwrozproszeniowa powoduje
Do pomiaru dawek indywidualnych u osób narażonych zawodowo na promieniowanie rentgenowskie są stosowane
Planowany obszar napromieniania PTV obejmuje
Pojawienie się w zapisie EKG patologicznego załamka Q lub QS może wskazywać na
Hiperfrakcjonowanie dawki w teleradioterapii polega na napromienianiu 2 do 3 razy dziennie dawką frakcyjną
W standardowym badaniu elektrokardiologicznym elektrodę C4 należy umocować
Pozytywny środek cieniujący najczęściej stosowany w rentgenodiagnostyce powinien charakteryzować się
Jak oznacza się w radioterapii obszar tkanek zawierający GTV i mikrorozsiewy w fazie niewykrywalnej klinicznie?
Cholangiografia to badanie radiologiczne
W lampie rentgenowskiej promieniowanie X powstaje w wyniku hamowania
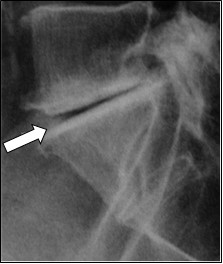
Na rentgenogramie strzałką zaznaczono
Do zadań technika elektroradiologa w pracowni hemodynamicznej należy
Która sekwencja obrazowania MR wykorzystuje impulsy RF o częstotliwości rezonansowej tłuszczu do tłumienia sygnału pochodzącego z tkanki tłuszczowej?
W pozytonowej tomografii emisyjnej PET zostaje zarejestrowane promieniowanie powstające podczas
W badaniu mammograficznym jedną z podstawowych projekcji jest projekcja
W badaniu audiometrycznym rezerwa ślimakowa to odległość między krzywą
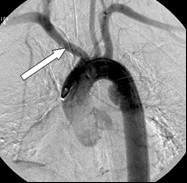
Na obrazie cyfrowej angiografii subtrakcyjnej strzałką zaznaczono
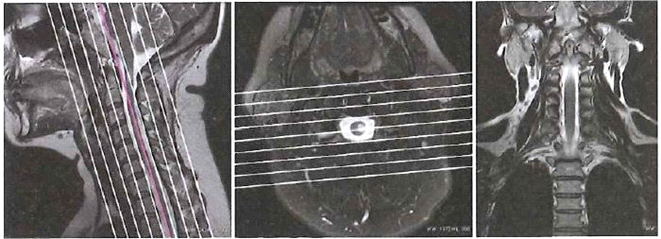
Obrazy MR kręgosłupa szyjnego przedstawiają etap planowania badania warstw
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
Zamieszczone na ilustracji obrazy dotyczą badania
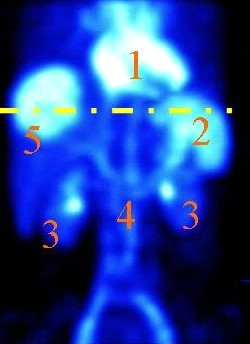
Który narząd na obrazie scyntygrafii znakowanej erytrocytami zaznaczono cyfrą 2?
Który radioizotop jest emiterem promieniowania alfa?
Pielografia zstępująca umożliwia diagnostykę
W badaniu audiometrycznym do oceny przewodnictwa kostnego wybranego ucha słuchawkę kostną należy przyłożyć do
Do środków kontrastujących negatywnych należą
Brachyterapia wewnątrzprzewodowa jest stosowana w leczeniu
W trakcie obrazowania metodą rezonansu magnetycznego wykorzystywane jest zjawisko wysyłania sygnału emitowanego przez
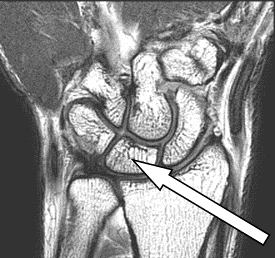
Na zamieszczonym obrazie RM nadgarstka lewego strzałką wskazano kość
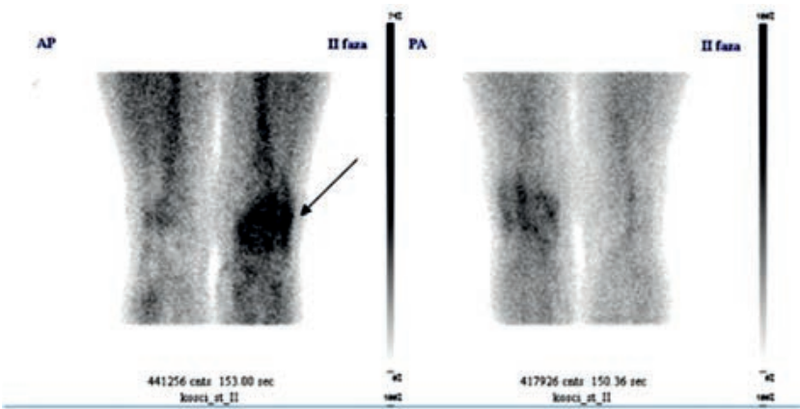
Na przedstawionym scyntygramie ukazano duży obszar
W metodzie RM (rezonansu magnetycznego) po umieszczeniu pacjenta w silnym, stałym polu magnetycznym dochodzi do oddziaływania
Rozpoczęcie badania TK nerek po 20-30 sekundach od początku podania środka kontrastowego umożliwia diagnostykę
W radioterapii konwencjonalnej pacjent jest leczony promieniowaniem pochodzącym
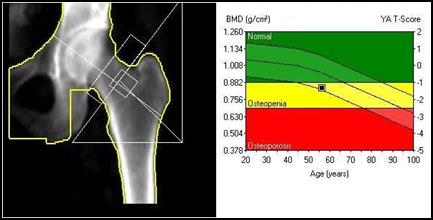
Która metoda diagnostyczna służy do określenia gęstości minerału kostnego w ujęciu objętościowym g/cm³?
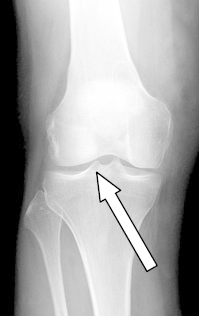
Którą strukturę anatomiczną oznaczono strzałką na radiogramie stawu kolanowego?
W badaniu EKG różnice potencjałów pomiędzy lewym podudziem a lewym przedramieniem rejestruje odprowadzenie
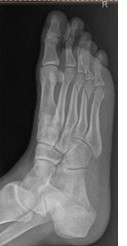
Na rentgenogramie stopy uwidocznione jest złamanie