Pytanie 1
Podczas przygotowywania roztworu mianowanego kwasu solnego o określonym stężeniu należy:
Wynik: 26/40 punktów (65,0%)
Wymagane minimum: 20 punktów (50%)
Podczas przygotowywania roztworu mianowanego kwasu solnego o określonym stężeniu należy:
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Którego odczynnika należy użyć do przygotowania roztworu wzorcowego, zawierającego jony \( \text{Fe}^{3+} \)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przygotować 200 g roztworu chlorku potasu o stężeniu 5% (m/m), ile substancji należy zastosować?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przykładem piany stałej jest
| faza rozproszona | faza rozpraszająca | ||
|---|---|---|---|
| gaz | ciecz | ciało stałe | |
| gaz | - | piana | piana stała |
| ciecz | aerozol ciekły | emulsja | emulsja stała |
| ciało stałe | aerozol stały | zol | zol stały |
Destylacja to metoda
Na etykietach substancji chemicznych można znaleźć oznaczenia literowe R i S (zgodnie z regulacjami CLP: H i P), które wskazują
W celu przeprowadzenia opisanego doświadczenia, należy przygotować:
| Opis procesu wydzielenia kwasu acetylosalicylowego z tabletek |
|---|
| Pięć rozgniecionych tabletek aspiryny (polopiryny) umieszcza się w kolbie stożkowej o pojemności 100 ml, dodaje 10 ml etanolu i ogrzewa na łaźni wodnej, aż do momentu rozpadnięcia się tabletek. W roztworze znajduje się kwas acetylosalicylowy, natomiast masa tabletkowa pozostaje w osadzie. Osad ten odsącza się na ogrzanym lejku szklanym zaopatrzonym w sączek karbowany. Do odebiornego przesączu dodaje się 20-30 ml zimnej wody destylowanej. Dodatek wody powoduje wypadanie osadu aspiryny z roztworu (zmniejsza się rozpuszczalność aspiryny w roztworze wodno-alkoholowym). Wydzielone kryształy odsączyć na lejku sitowym i suszyć na powietrzu. |
Proces wydobywania składnika z cieczy lub ciała stałego w mieszance wieloskładnikowej poprzez jego rozpuszczenie w odpowiednim rozpuszczalniku to
W trakcie kalibracji stężenia roztworu kwasu solnego na przynajmniej przygotowany roztwór zasady sodowej ma miejsce reakcja
Na podstawie danych w tabeli określ, jaką masę próbki należy pobrać, jeżeli wielkość ziarna wynosi 1·10-5 m.
| Wielkość ziaren lub kawałków [mm] | Poniżej 1 | 1-10 | 11-50 | Ponad 50 |
|---|---|---|---|---|
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
Proces usuwania substancji z cieczy lub wydobywania składnika z mieszanin cieczy, oparty na równowadze fazowej ciecz-gaz, nazywa się
Ile węglanu sodu trzeba odmierzyć, aby uzyskać 200 cm3 roztworu o stężeniu 8% (m/v)?
Aby przeprowadzić syntezę substancji organicznej w temperaturze 150°C, należy zastosować łaźnię
Aby uzyskać Cr2O3, dichromian(VI) amonu został poddany rozkładowi. Po rozpoczęciu, egzotermiczna reakcja rozkładu przebiega samorzutnie.
(NH4)2Cr2O7 → Cr2O3 + 4 H2O + N2 Jak oceniasz zakończenie tej reakcji?
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
Wybierz poprawny zapis jonowy spośród podanych reakcji, w których otrzymywany jest siarczan(VI) baru.
Etykieta roztworu kwasu azotowego(V) o koncentracji 6 mol/dm3 powinna zawierać nazwę substancji oraz
Jakie jest przeznaczenie pieca muflowego?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Piktogram ukazujący czaszkę oraz skrzyżowane kości piszczelowe jest typowy dla substancji o działaniu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który z wymienionych roztworów NaOH, o określonych stężeniach, nie jest roztworem mianowanym?
Aby oddzielić połączenia szlifów, należy w miejscu ich styku wprowadzić
Nie należy używać gorącej wody do mycia
W przypadku zanieczyszczeń szklanych naczyń osadami o charakterze nieorganicznym, takimi jak wodorotlenki, tlenki oraz węglany, do ich oczyszczania używa się
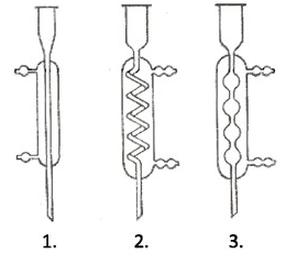
Rysunek przedstawia chłodnice:
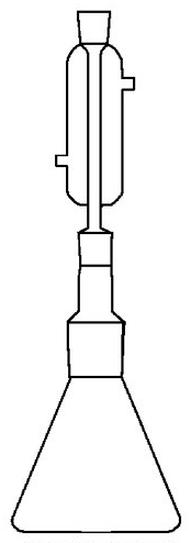
Sprzęt laboratoryjny przedstawiony na ilustracji stanowi element zestawu do

Aby uzyskać drobnokrystaliczny osad BaSO4, należy wykonać poniższe kroki:
Do zlewki wlać 20 cm3 roztworu BaCl2, następnie dodać 100 cm3 wody destylowanej oraz kilka kropli roztworu HCl. Zawartość zlewki podgrzać na łaźni wodnej, a potem, ciągle mieszając, dodać 35 cm3 roztworu H2SO4.
Mieszaninę ogrzewać na łaźni wodnej przez 1 godzinę. Osad odsączyć i przepłukać kilkakrotnie gorącą wodą zakwaszoną kilkoma kroplami roztworu H2SO4.
Według przedstawionej procedury, do uzyskania osadu BaSO4 potrzebne są:
Wskaź sprzęt laboratoryjny, który znajduje się w zestawie do filtracji pod obniżonym ciśnieniem?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do przechowywania zamrożonych próbek wody stosuje się naczynia wykonane
Zestaw przedstawiony na rysunku może służyć do
Reagenty o czystości na poziomie 99,999% — 99,9999% to reagenty
Naczynia miarowe kalibrowane "na wlew" mają oznaczenie w postaci symbolu
Na podstawie danych zawartych w tabeli określ, do oznaczania którego parametru próbka musi być utrwalona w niskim pH.
| Oznaczany parametr | Rodzaj naczynia do przechowywania | Sposób utrwalania | Dopuszczalny czas przechowywania |
|---|---|---|---|
| barwa | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C | 24 h |
| fosforany ogólne | szklane lub polietylenowe | - zakwaszenie kwasem siarkowym(VI) - schłodzenie do temperatury 2-5°C | 4 h 48 h |
| BZT | szklane | - schłodzenie do temperatury 2-5°C - przechowywanie w ciemności | 24 h |
| azot azotanowy(V) | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C - dodanie 2 cm3 chloroformu do 1 dm3 próbki | 24 h 48 h |
W którym wierszu tabeli podano ilości substancji i wody, potrzebne do sporządzenia 350 g roztworu o stężeniu 7%?
| Masa substancji | Masa wody | |
|---|---|---|
| A. | 24,5 g | 350 g |
| B. | 24,5 g | 325,5 g |
| C. | 7 g | 343 g |
| D. | 7 g | 350 g |