Pytanie 1
Które ciało obce w obszarze badania nie stanowi przeciwwskazania do wykonania MR?
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Które ciało obce w obszarze badania nie stanowi przeciwwskazania do wykonania MR?
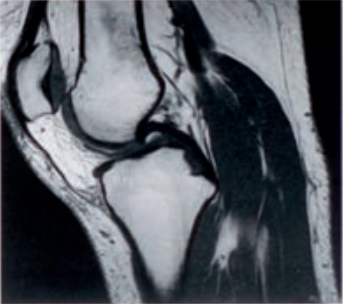
Którą metodę badania zastosowano w obrazowaniu stawu kolanowego?
Odprowadzenie II rejestruje różnicę potencjałów między
Zamieszczone na ilustracji obrazy dotyczą badania
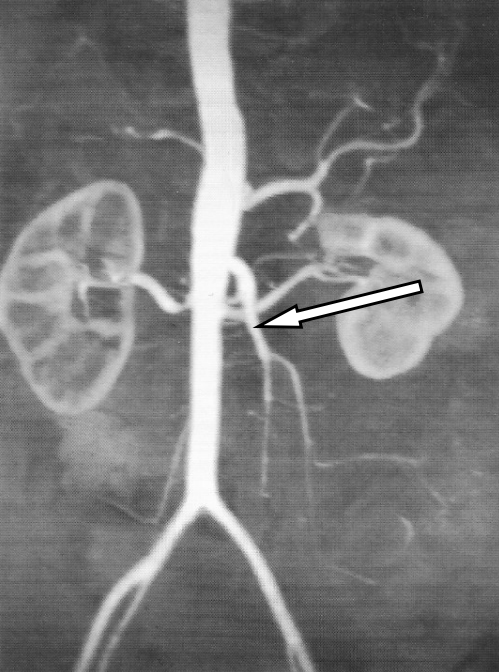
Którą tętnicę zaznaczono strzałką na obrazie MR?
Odprowadzenie EKG mierzące różnicę potencjałów między lewym podudziem a prawym przedramieniem oznacza się jako
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
Na prawidłowo wykonanym zdjęciu zatok w projekcji PA górny zarys piramid rzutuje się
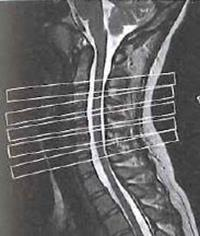
Na którym obrazie MR jest widoczne pasmo saturacji?
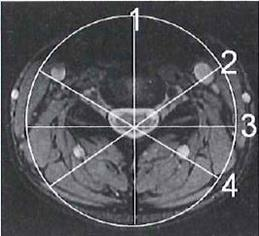

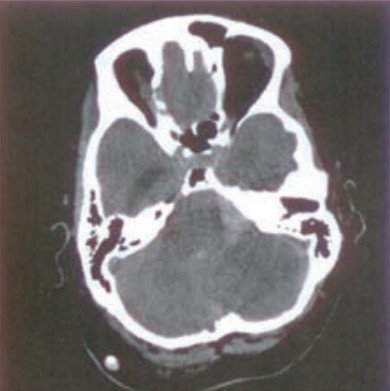
Na obrazie uwidoczniono
Za wyrównanie ciśnienia między uchem środkowym a otoczeniem odpowiada
Zamieszczony elektrokardiogram przedstawia
Którą kasetę należy wykorzystać do wykonania rentgenogramu klatki piersiowej w projekcji bocznej u 35-letniej pacjentki o wzroście 165 cm i wadze 54 kg?
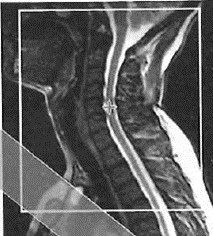
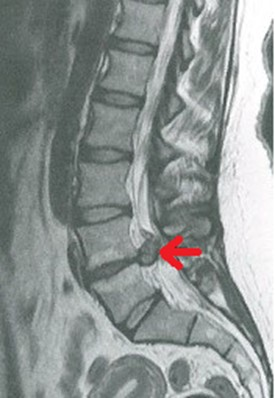
Na obrazie MR kręgosłupa lędźwiowego strzałką wskazano
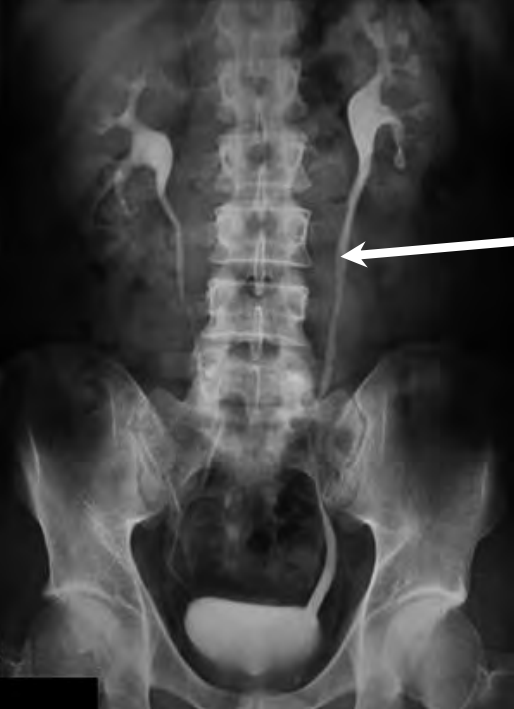
Na prawidłowo przedstawionym radiogramie badania kontrastowego strzałką zaznaczono
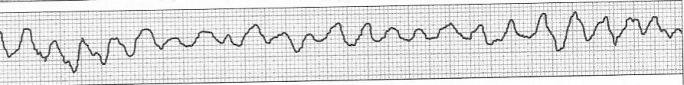
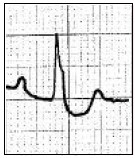
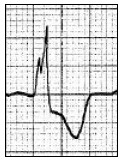
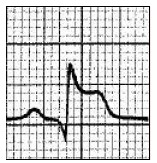
Który zapis EKG przedstawia falę Pardee'go?

Droga przewodnictwa powietrznego fali akustycznej przebiega przez
W celu wyeliminowania zakłóceń obrazu MR przez sygnały pochodzące z tkanki tłuszczowej, stosuje się
Która właściwość promieniowania X pozwala na skierowanie promienia centralnego na wybrany punkt topograficzny podczas wykonywania badania radiologicznego?
Zgodnie z obowiązującą procedurą radiologiczną zdjęcie jamy brzusznej przy podejrzeniu zapalenia nerek zostanie wykonane w projekcji
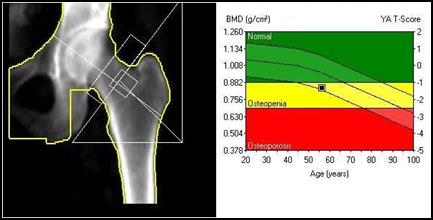
Przyczyną zaniku kostnego jest
Kolonoskopia to badanie, które ma na celu ocenę błony śluzowej
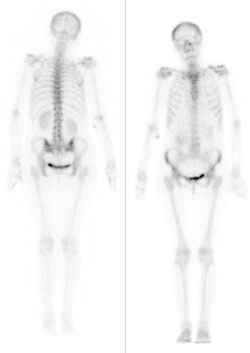
Zamieszczony obraz został wykonany metodą
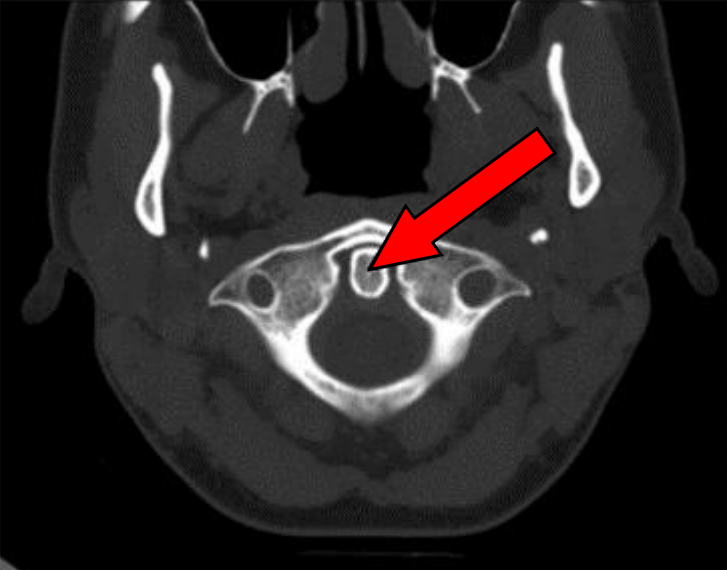
Na przekroju poprzecznym TK kręgosłupa szyjnego strzałką wskazano
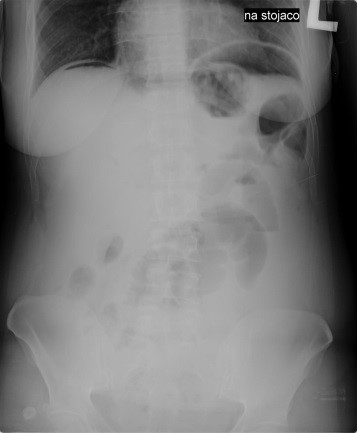
Radiogram jamy brzusznej uwidacznia
Brachyterapia wewnątrzprzewodowa jest stosowana w leczeniu
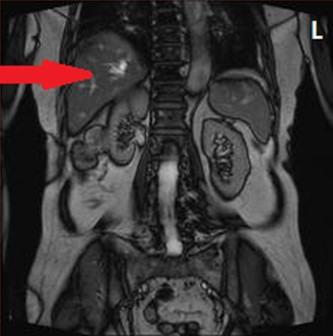
Na obrazie MR jamy brzusznej strzałką wskazano
Przy ułożeniu do zdjęcia AP czaszki płaszczyzna
Jednym z kryteriów poprawnie wykonanego badania spirometrycznego jest czas trwania natężonego wydechu, który powinien wynosić u osób powyżej 10 roku życia co najmniej
Rozpraszanie promieniowania X, w wyniku którego następuje zwiększenie długości fali promieniowania, to zjawisko
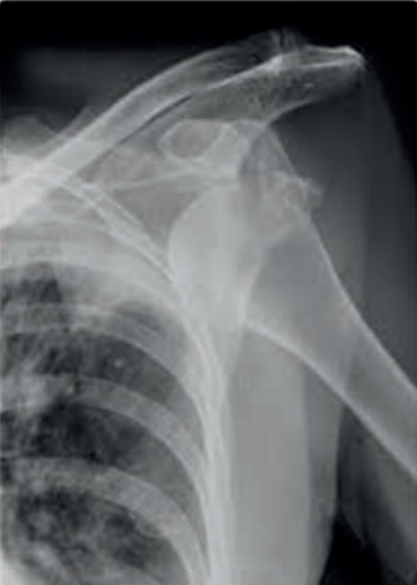
Co zostało uwidocznione na zamieszczonym radiogramie?
Jakie symbole mają odprowadzenia kończynowe dwubiegunowe w badaniu EKG?
Przemiana promieniotwórcza radu w ren opisana wzorem \( {}_{88}^{226}\text{Ra} \to {}_{86}^{222}\text{Rn} + {}_{2}^{4}\text{He} \) jest rozpadem
Obszary napromieniania w technice IMRT w trakcie wykonywania zabiegu radioterapeutycznego wyznacza
Jakie wymagania techniczne muszą spełniać aparaty terapeutyczne stosowane w zakładach brachyterapii, służące bezpośrednio do napromieniania pacjenta metodą zdalnego wprowadzania źródeł promieniotwórczych?
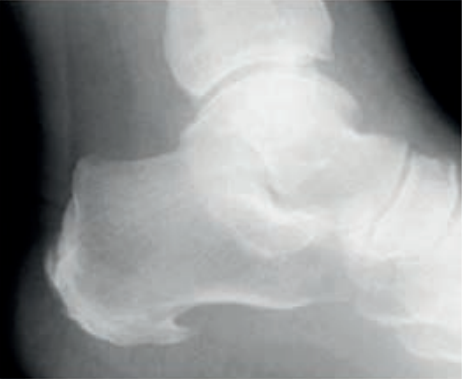
Którą patologię uwidoczniono na zamieszczonym rentgenogramie?
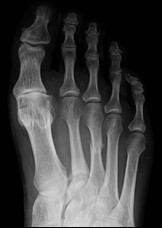
Na radiogramie stopy uwidocznione jest złamanie trzonu
Jak oznacza się w radioterapii obszar tkanek zawierający GTV i mikrorozsiewy w fazie niewykrywalnej klinicznie?
Zgodnie z procedurą wzorcową w badaniu MR należy ułożyć pacjenta na brzuchu do diagnostyki
Rutynowe badanie koronarografii prawej tętnicy wieńcowej wykonywane jest w rzucie skośnym przednim