Pytanie 1
Podczas badania EEG w systemie „10-20” literą A oznacza się elektrody
Wynik: 33/40 punktów (82,5%)
Wymagane minimum: 20 punktów (50%)
Podczas badania EEG w systemie „10-20” literą A oznacza się elektrody
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
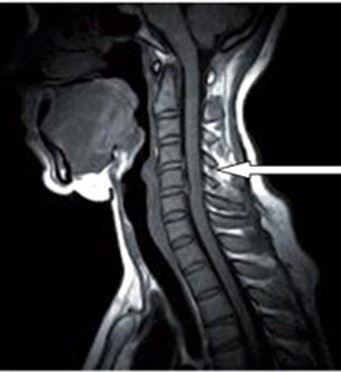
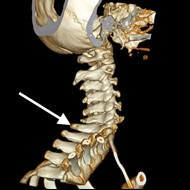
Na obrazie rezonansu magnetycznego strzałką oznaczono wyrostek kolczysty kręgu
Po wykonanej radioterapii do dokumentacji pacjenta należy wpisać dawkę promieniowania w jednostce
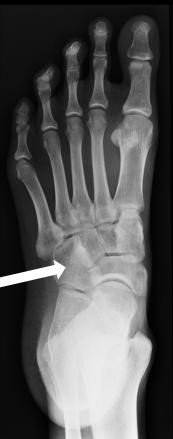
Którą kość zaznaczono strzałką na radiogramie stopy?
Wysoką rozdzielczość przestrzenną obrazowania MR uzyskuje się przez
Na obrazie rentgenowskim strzałką zaznaczono
Jakie wymagania techniczne muszą spełniać aparaty terapeutyczne stosowane w zakładach brachyterapii, służące bezpośrednio do napromieniania pacjenta metodą zdalnego wprowadzania źródeł promieniotwórczych?
W której projekcji należy wykonać badanie radiologiczne kręgosłupa lędźwiowego, by na otrzymanym zdjęciu wyrostki kręgów lędźwiowych układały się w charakterystyczny kształt piesków (teriera szkockiego)?
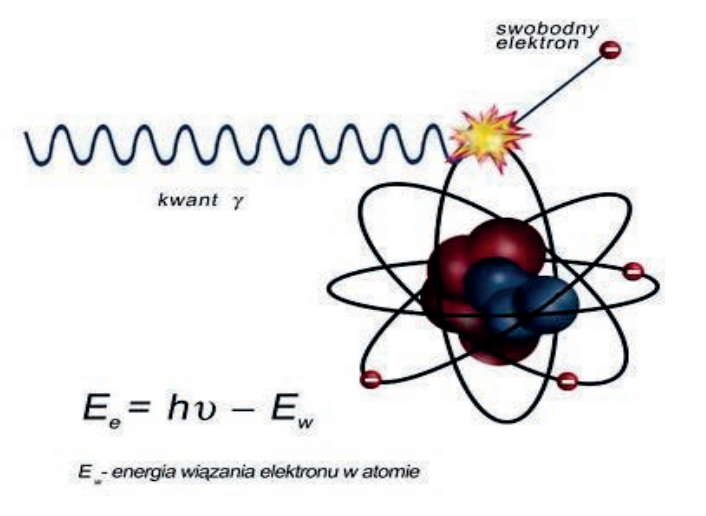
Na zamieszczonej rycinie przedstawiono
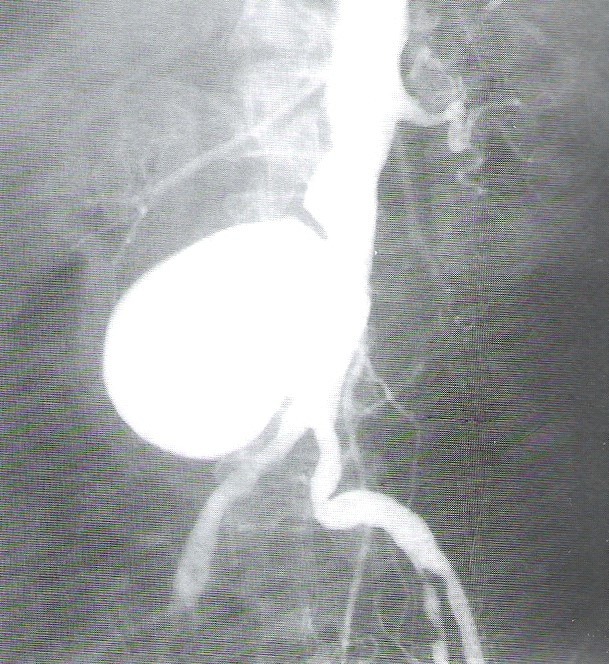
Badanie polegające na wprowadzeniu cewnika przez pęcherz moczowy do moczowodu i miedniczki nerkowej i podaniu środka kontrastującego to
Którą metodą zostało wykonane badanie kręgosłupa zobrazowane na zdjęciu?
HRCT (high-resolution computed tomography) jest metodą obrazowania TK
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
W scyntygrafii serca metoda bramkowanej akwizycji SPECT umożliwia między innymi ocenę frakcji wyrzutowej
Gdzie znajduje się węzeł zatokowo-przedsionkowy wywołujący rytmiczne skurcze mięśnia serca?
Ile razy i jak zmieni się wartość natężenia promieniowania X przy zwiększeniu odległości OF ze 100 cm do 200 cm?
Rytm alfa i beta rejestruje się podczas badania
„Ognisko zimne” w obrazie scyntygraficznym oznacza
Fala głosowa rozchodzi się
Brachyterapia wewnątrzprzewodowa jest stosowana w leczeniu
W systemie międzynarodowym czwarty górny ząb mleczny po stronie prawej oznacza się symbolem
Badanie przewodu pokarmowego metodą podwójnego kontrastu wiąże się z podaniem pacjentowi
Brachyterapia polegająca na wielokrotnym wsuwaniu i wysuwaniu źródła promieniowania do tego samego aplikatora nosi nazwę
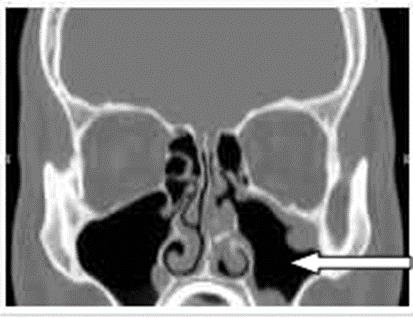
Na zamieszczonym obrazie TK strzałką zaznaczono zatokę
W standardowym badaniu elektrokardiologicznym elektrodę C4 należy umocować
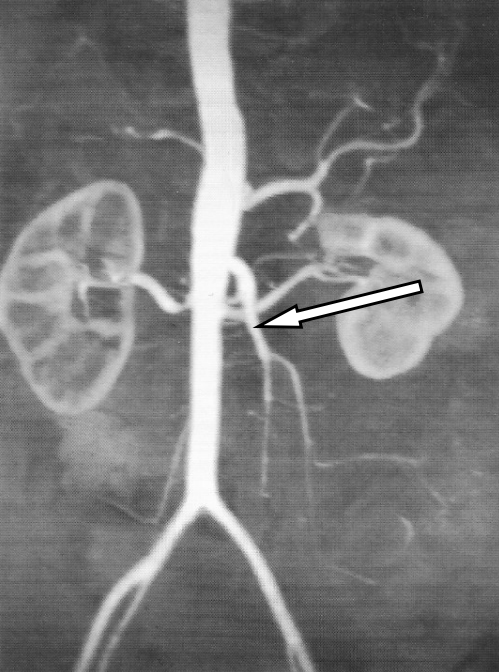
Którą tętnicę zaznaczono strzałką na obrazie MR?
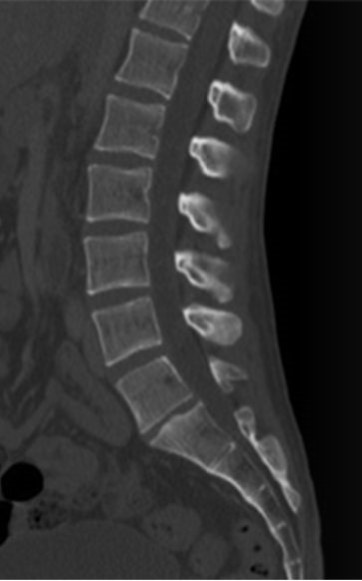
Na obrazie TK kręgosłupa strzałką wskazano wyrostek
W lampie rentgenowskiej promieniowanie X powstaje w wyniku hamowania
W badaniu EKG różnice potencjałów pomiędzy lewym podudziem a lewym przedramieniem rejestruje odprowadzenie
Jak oznacza się w systemie międzynarodowym czwarty górny ząb mleczny po stronie prawej?
W medycznym przyspieszaczu liniowym jest generowana wiązka fotonów o energii w zakresie
Jaki sposób frakcjonowania dawki jest stosowany w radioterapii konwencjonalnej?
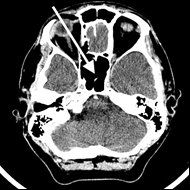
Na radiogramie TK głowy strzałką wskazano
W obrazowaniu MR do uwidocznienia naczyń krwionośnych jest stosowana sekwencja
Który załamek w zapisie EKG odpowiada zjawisku depolaryzacji przedsionków mięśnia sercowego?
Rak drobnokomórkowy i rak niedrobnokomórkowy to postacie organiczne nowotworów złośliwych
Rumień skóry pojawiający się podczas radioterapii jest objawem
Dobierz dla standardowego pacjenta projekcję, pozycję i sposób ułożenia kasety o wymiarach 30 cm x 40 cm do zdjęcia przeglądowego układu moczowego.
| Projekcja | Pozycja | Ułożenie kasety | |||
|---|---|---|---|---|---|
| 1. | AP | 3. | stojąca | 5. | poprzeczne |
| 2. | PA | 4. | leżąca | 6. | podłużne |
Bezwzględnym przeciwwskazaniem do wykonania badania rezonansem magnetycznym jest