Pytanie 1
Fala głosowa rozchodzi się
Wynik: 39/40 punktów (97,5%)
Wymagane minimum: 20 punktów (50%)
Fala głosowa rozchodzi się
Nieostrość geometryczna obrazu rentgenowskiego zależy od
Celem radioterapii paliatywnej nie jest
W scyntygrafii kośćca „ogniska gorące” oznaczają miejsca
W której projekcji należy wykonać badanie radiologiczne kręgosłupa lędźwiowego, by na otrzymanym zdjęciu wyrostki kręgów lędźwiowych układały się w charakterystyczny kształt piesków (teriera szkockiego)?
Co jest przyczyną artefaktu widocznego na obrazie MR?
Jaka jest odległość pomiędzy źródłem promieniowania a powierzchnią ciała pacjenta w technice izocentrycznej radioterapii?
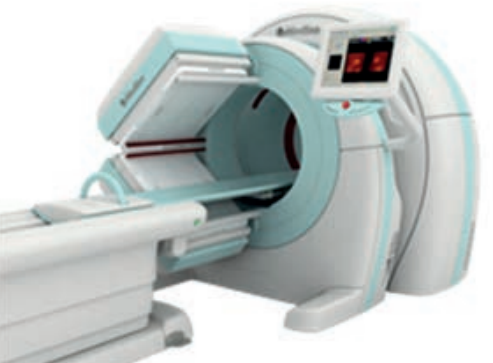
Które urządzenie zostało przedstawione na fotografii i w jakiej pracowni znajduje zastosowanie?
Największa wartość energii promieniowania stosowanego w radioterapii jest generowana przy użyciu
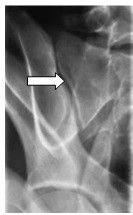
Którą strukturę anatomiczną zaznaczono strzałką na rentgenogramie?
Który załamek w zapisie EKG odpowiada zjawisku depolaryzacji przedsionków mięśnia sercowego?
Jak określa się rekonstrukcję obrazów TK, której wynikiem są obrazy dwuwymiarowe tworzone w dowolnej płaszczyźnie przez wtórną obróbkę zestawionych ze sobą wielu przekrojów poprzecznych?
Jakie symbole mają odprowadzenia kończynowe dwubiegunowe w badaniu EKG?
Jak zgodnie ze standardem należy ustawić pacjenta do badania rentgenowskiego w skosie tylnym prawym?
Do zdjęcia rentgenowskiego kręgosłupa piersiowego w projekcji AP pacjenta należy ułożyć
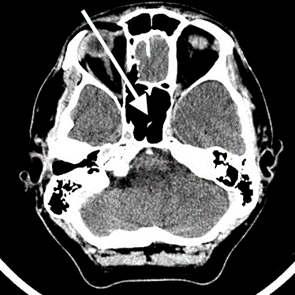
Na przedstawionym radiogramie TK głowy strzałką zaznaczono
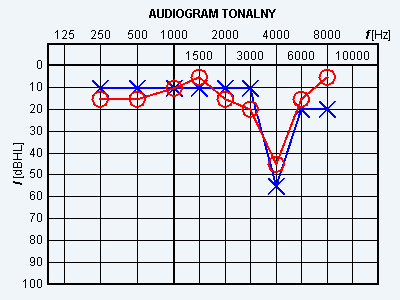
Wynik badania słuchu metodą audiometrii tonalnej wskazuje na
Które urządzenia pomocnicze służą do unieruchomienia pacjenta do zabiegu radioterapii?
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Jak oznacza się w radioterapii obszar tkanek zawierający GTV i mikrorozsiewy w fazie niewykrywalnej klinicznie?
Na zamieszczonej rycinie przedstawiono
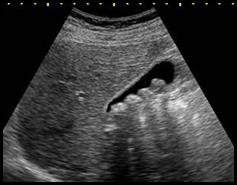
Którą strukturę anatomiczną uwidoczniono na zamieszczonym obrazie USG?
W badaniu EKG elektrodę przedsercową V4 należy umocować
W zapisie EKG prawidłowego rytmu zatokowego wszystkie załamki P są
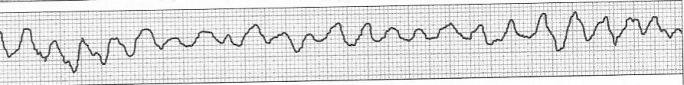
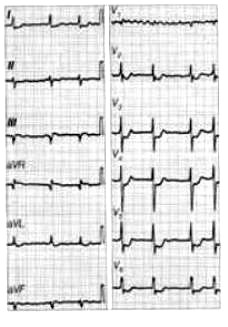
Zamieszczony elektrokardiogram przedstawia
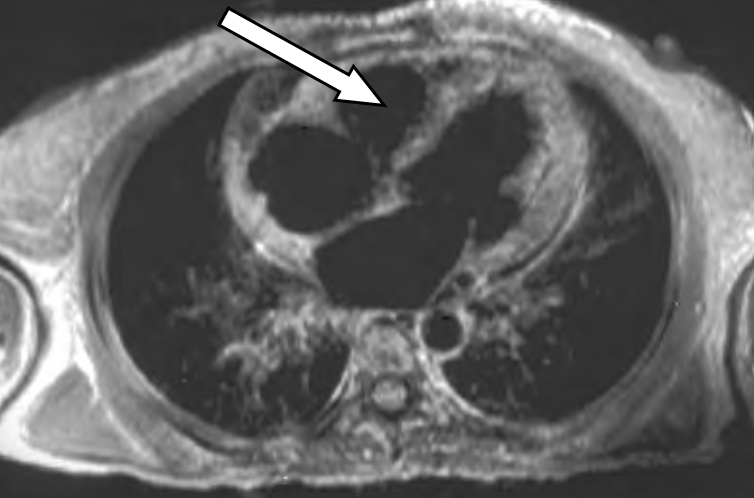
Na skanie rezonansu magnetycznego serca oznaczono
W medycynie nuklearnej wykorzystuje się:
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
Wysoką rozdzielczość przestrzenną obrazowania MR uzyskuje się przez
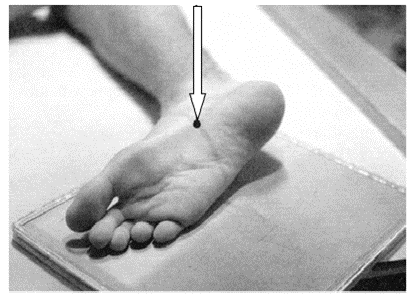
Na zamieszczonej ilustracji przedstawiono ułożenie pacjenta do wykonania zdjęcia rentgenowskiego
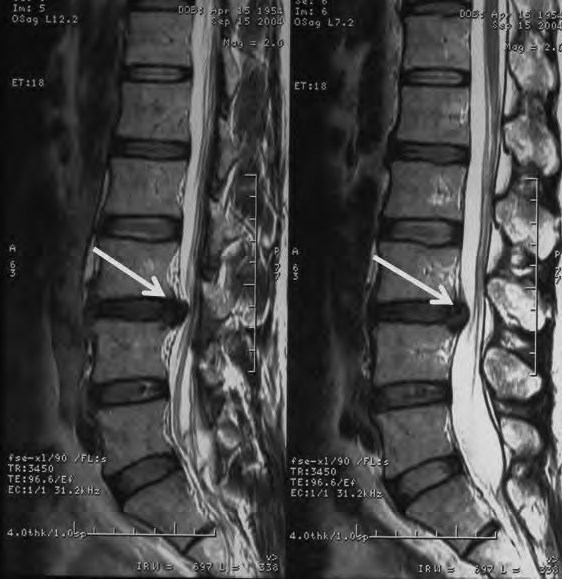
Na obrazie RM uwidoczniono odcinek kręgosłupa
Zastosowana w badaniu radiologicznym kratka przeciwrozproszeniowa powoduje
Kryterium rozpoznawczym dla fali δ (delta) w badaniu EKG jest
Którym skrótem oznacza się tomografię komputerową wysokiej rozdzielczości?
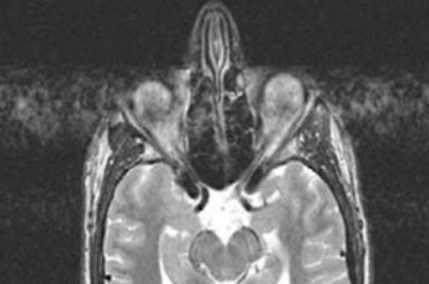
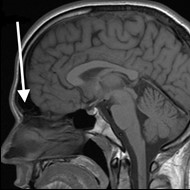
Na obrazie rezonansu magnetycznego głowy strzałką wskazano zatokę
W pozytonowej emisyjnej tomografii komputerowej PET radioznacznik podawany jest pacjentowi najczęściej
Który radioizotop stosuje się do badania scyntygraficznego kości?
W badaniu MR nadgarstka w ułożeniu na supermana pacjent leży na
Na elektrokardiogramie uwidoczniono
Zgodnie ze standardami do wykonania zdjęcia bocznego czaszki, należy zastosować kasetę o wymiarze