Pytanie 1
Znak umieszczony w pracowni rezonansu magnetycznego zakazuje wstępu osobom

Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Znak umieszczony w pracowni rezonansu magnetycznego zakazuje wstępu osobom

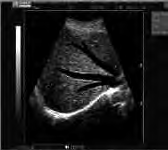
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Promieniowanie rentgenowskie jest
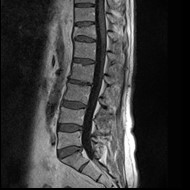
Na obrazie uwidoczniono złamanie kompresyjne kręgu
Testy podstawowe z zakresu geometrii pola rentgenowskiego, przeznaczone do sprawdzenia zgodności pola wiązki promieniowania rentgenowskiego z symulacją świetlną, są wykonywane raz
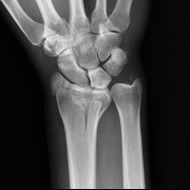
Na obrazie radiologicznym nadgarstka uwidoczniono złamanie nasady
Osłony na gonady dla osób dorosłych powinny posiadać równoważnik osłabienia promieniowania nie mniejszy niż
Który narząd został oznaczony strzałką na obrazie rezonansu magnetycznego?
Przy podejrzeniu ciała obcego w oczodole należy wykonać
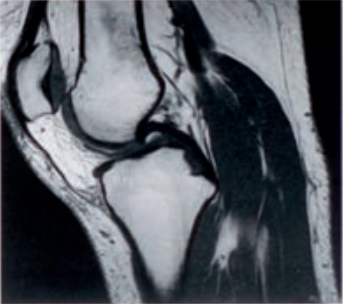
Którą metodę badania zastosowano w obrazowaniu stawu kolanowego?
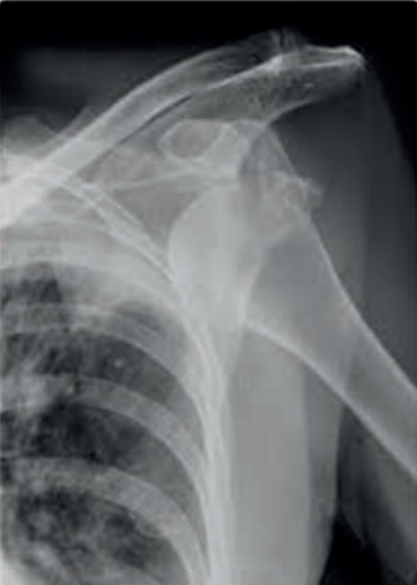
Którą patologię uwidoczniono na zamieszczonym rentgenogramie?
Parametrem krwi, który powinien zostać oznaczony u pacjenta przed wykonaniem badania MR z kontrastem, jest
Który zestaw zdjęć narządów klatki piersiowej należy wykonać u pacjenta z podejrzeniem lewostronnego zapalenia płuc?
Do zadań technika elektroradiologa w pracowni hemodynamicznej należy
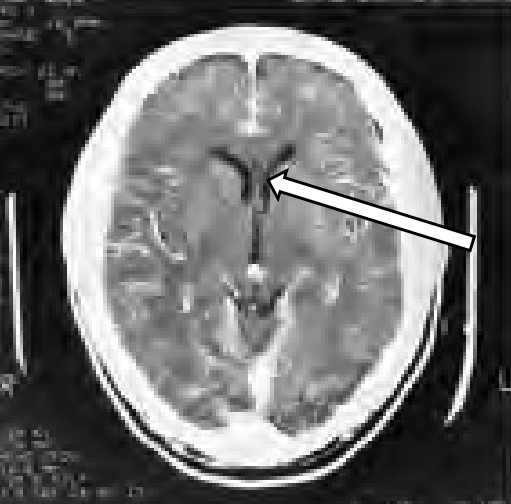
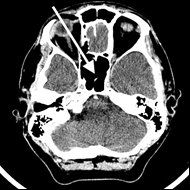
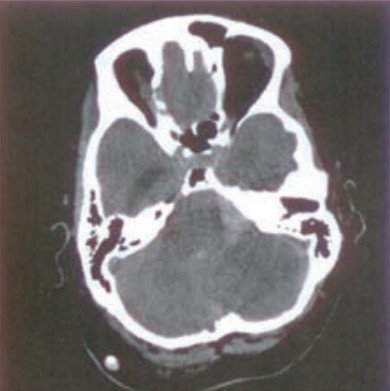
Na radiogramie TK głowy strzałką wskazano
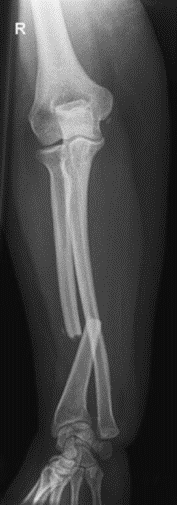
Na radiogramie uwidoczniono złamanie
Podczas wykonywania zdjęcia rentgenowskiego lewobocznego czaszki promień centralny powinien przebiegać
Zamieszczony obraz został wykonany metodą
Ligand stosuje się
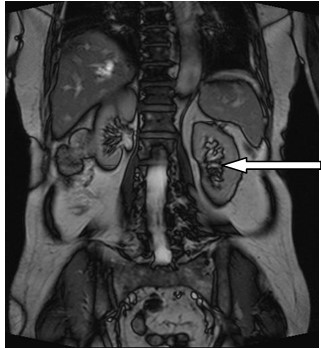
Na obrazie ultrasonograficznym jamy brzusznej uwidoczniono
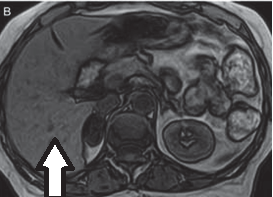
Rozpoczęcie badania TK nerek po 20-30 sekundach od początku podania środka kontrastowego umożliwia diagnostykę
Głowica typu convex w USG służy do badania
W ultrasonografii występuje zależność:
Na przekroju poprzecznym rezonansu magnetycznego strzałką oznaczono
Po zakończeniu badania angiograficznego należy zapisać w dokumentacji medycznej pacjenta:
Folia wzmacniająca umieszczona w kasecie rentgenowskiej emituje pod wpływem promieniowania X światło
Zamieszczone obrazy związane są z badaniem
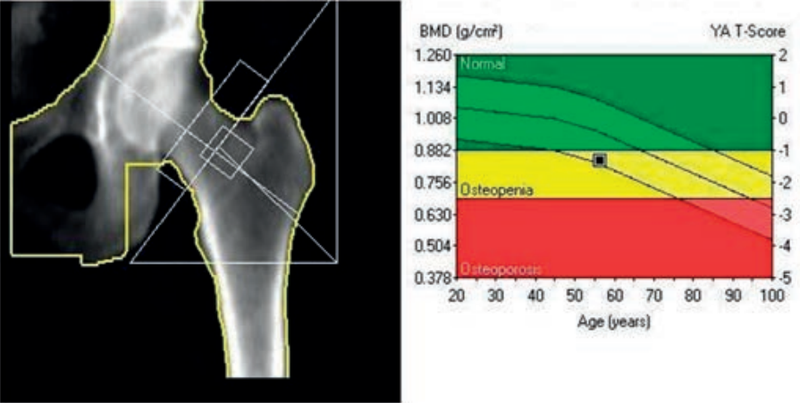
Zwiększenie napięcia na lampie rentgenowskiej powoduje
W diagnostyce metodą rezonansu magnetycznego biorą udział
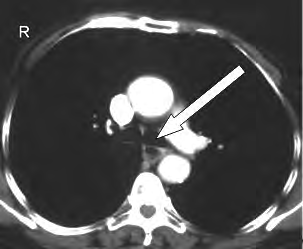
Na obrazie TK klatki piersiowej w przekroju poprzecznym strzałką oznaczono
Świeżo wynaczyniona krew na obrazach TK głowy bez podania środka kontrastowego ukazuje się jako obszar
DSA to cyfrowa
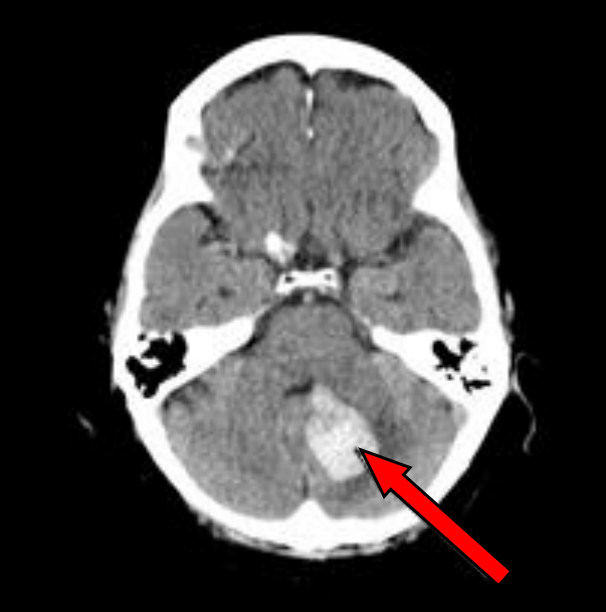
Na przekroju poprzecznym TK mózgu strzałką wskazano obszar
Do zdjęcia prawych otworów międzykręgowych kręgosłupa szyjnego pacjent stoi w skosie
Do badania MR nadgarstka pacjenta należy ułożyć
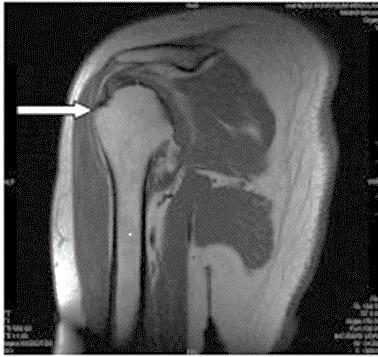
Którą strukturę anatomiczną oznaczono na zamieszczonym obrazie rezonansu magnetycznego?
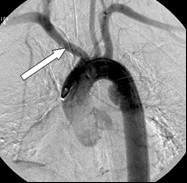
Na obrazie cyfrowej angiografii subtrakcyjnej strzałką zaznaczono
Parametr SNR w obrazowaniu MR oznacza
Obrazowanie w sekwencjach STIR, FLAIR, SE wykonywane jest w badaniu
Którą strukturę anatomiczną oznaczono na skanie TK głowy?