Pytanie 1
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Zgłębniki o konstrukcji przypominającej świder są wykorzystywane do pobierania próbek różnych materiałów
Która część małej partii materiału jest najczęściej pobierana w celu przygotowania próbki ogólnej?
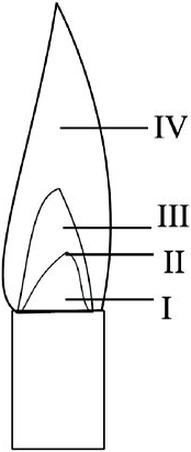
Na rysunku przedstawiającym płomień palnika gazowego najwyższa temperatura płomienia znajduje się w strefie
Oblicz, jaką ilość węglanu sodu w gramach należy przygotować, aby uzyskać 500 cm3 roztworu tej soli o stężeniu 0,1000 mol/dm3.
MNa = 23 g/mol, MC = 12 g/mol, MO = 16 g/mol
200 g soli zostało poddane procesowi oczyszczania poprzez krystalizację. Uzyskano 125 g czystego produktu. Jaką wydajność miała krystalizacja?
Materiały wykorzystywane w laboratoriach, mogące prowadzić do powstawania mieszanin wybuchowych, powinny być przechowywane
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Skuteczny środek do osuszania
Piktogram nie jest konieczny dla
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką masę siarczanu(VI) miedzi(II)-woda(1/5) należy poddać suszeniu, aby otrzymać 300 g soli bezwodnej?
| CuSO4 · 5H2O → CuSO4 + 5H2O |
| (MCuSO4·5H2O = 249,5 g/mol, MCuSO4 = 159,5 g/mol, MH2O = 18,0 g/mol) |
Wskaż zbiór substancji, które po rozpuszczeniu w wodzie stają się elektrolitami?
Odpady z rozpuszczalników organicznych, takich jak benzen czy aceton, zawierające co najmniej 80% danego rozpuszczalnika, należy
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
Symbol "In" znajduje się na
Próbka, którą analizujemy, to bardzo rozcieńczony wodny roztwór soli nieorganicznych, który ma być poddany analizie. Proces, który można zastosować do zagęszczenia tego roztworu, to
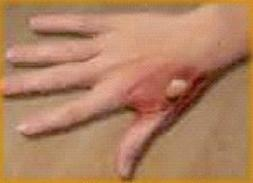
Zdjęcie przedstawia oparzenie cieplne
Urządzeniem pomiarowym nie jest
Gęstość próbki cieczy wyznacza się przy użyciu
W laboratorium chemicznym przewody instalacji rurowych są oznaczane różnymi kolorami, zgodnie z obowiązującymi normami. Polska Norma PN-70 N-01270/30 określa kolor dla wody jako
Wody pobrane ze studni powinny być przewożone w szczelnie zamkniętych butelkach z przezroczystego materiału
W tabeli zestawiono objętości molowe czterech gazów odmierzone w warunkach normalnych.
Dla którego spośród wymienionych w tabeli gazów objętość molowa najbardziej odchyla się od wartości obliczonej dla gazu doskonałego?
| Gaz | SO2 | CHCl3(para) | O3 | NH3 |
|---|---|---|---|---|
| Objętość molowa (dm3/mol) | 21,89 | 22,60 | 21,6 | 22,08 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Reagenty o najwyższej czystości to reagenty
Piktogram ukazujący czaszkę oraz skrzyżowane kości piszczelowe jest typowy dla substancji o działaniu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Nie należy używać gorącej wody do mycia
Zjawisko fizyczne, które polega na rozkładaniu struktury krystalicznej substancji stałej oraz przenikaniu jej cząsteczek lub jonów do cieczy, nosi nazwę
Aby podnieść temperaturę roztworu do 330 K, jakie wyposażenie jest potrzebne?
Odczynnik, który nie został wykorzystany, należy zutylizować zgodnie z informacjami zawartymi na etykiecie
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jak nazywa się naczynie o płaskim dnie, które wykorzystuje się do pozyskiwania substancji stałej poprzez stopniowe odparowanie rozpuszczalnika z roztworu?
Które równanie przedstawia reakcję otrzymywania mydła?
| CH3COOH + NaOH →CH3COONa + H2O | 2 CH3COOH + Na2O →2 CH3COONa + H2O | 2 C2H5COOH + 2 Na →2 C2H5COONa + H2↑ | C17H35COOH + NaOH →C17H35COONa + H2O |
Materiał uzyskany przez zmieszanie prób pobranych w ustalonych odstępach czasu określa się mianem próbki
Proces oddzielania składników jednorodnej mieszaniny, polegający na eliminacji jednego lub większej ilości składników z roztworu lub substancji stałej przy użyciu odpowiednio wybranego rozpuszczalnika, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.